题目内容
5. 常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )
常温下,向20.00mL0.1000mol•L-1的醋酸溶液中逐滴加入0.1000mol•L-1的NaOH溶液,pH随NaOH溶液体积的变化如图所示.下列说法不正确的是( )| A. | 在反应过程中,c(Na+)+c(H+)=c(CH3COO-)+c(OH-) | |
| B. | pH=5时,c(CH3COO-)>c(Na+)>c(H+)>c(OH-) | |
| C. | pH=6时,c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.1000 mol•Lˉ1 | |
| D. | pH=7时,消耗NaOH溶液的体积小于20.00mL |
分析 A、根据电荷守恒分析解答;
B、pH=5时,溶液呈酸性,醋酸电离为主;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),两者混合PH=6,则醋酸过量;
D、如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性.
解答 解:A、根据电荷守恒可知:c(Na+)+c(H+)=c(CH3COO-)+c(OH-),故A正确;
B、pH=5时,溶液呈酸性,醋酸电离为主,所以离子浓度的大小为:c(CH3COO-)>c(Na+)>c(H+)>c(OH-),故B正确;
C、根据电荷守恒可知:c(Na+)+c(H+)=c(OH-)+c(CH3COO-),两者混合PH=6,则氢氧化钠溶液的体积小于20.00mL,物料守恒可知:c(CH3COO-)+c(CH3COOH)>0.05mol/L,所以c(Na+)+c(H+)-c(OH-)+c(CH3COOH)=0.05 mol•Lˉ1,故C错误;
D、如果消耗NaOH溶液的体积20.00mL,两者恰好完全反应生成醋酸钠,溶液水解呈碱性,而溶液呈中性,所以消耗NaOH溶液的体积小于20.00mL,故G正确;
故选C.
点评 本题考查酸碱混合的定性判断及溶液pH的计算,题目难度中等,明确各点对应溶质组成为解答关键,注意掌握电荷守恒、物料守恒及盐的水解原理在判断离子浓度大小中的应用,试题培养了学生的灵活应用能力.

练习册系列答案
相关题目
16.下列对于分子式为C4H8O2的有机物X的判断正确的是( )
| A. | X不一定属于烃的衍生物 | |
| B. | 能与NaHCO3反应的X有3种 | |
| C. | X的某些同分异构体之间可能发生取代反应 | |
| D. | 能与NaOH溶液反应的X都含有相同的官能团 |
20.下列物质不是黄色或淡黄色的是( )
| A. | 单质硫 | B. | 过氧化钠 | C. | 氢氧化铁胶体 | D. | 三氯化铁稀溶液 |
10.用NA表示阿伏伽德罗常数的数值,下列叙述正确的是( )
| A. | 25g质量分数为68%的H2O2水溶液中含有的氧原子数目为NA | |
| B. | 标准状况下,11.2LCH3OH中含有的共价键数目为2.5NA | |
| C. | 42g由丙烯(C3H6)和环丙烷(C3H6)组成的混合气体中含有的氧原子数目为6NA | |
| D. | 1L0.1mol•L-1NaHCO3溶液中HCO${\;}_{3}^{-}$和${CO}_{3}^{2-}$数目之和为0.1NA |
17.化学与生活息息相关,下列说法错误的是( )
| A. | 用SO2漂白过的草帽辫日久会变色 | |
| B. | 硅胶多孔,常用作食品干燥剂和催化剂的载体 | |
| C. | 用灼烧和闻气味的方法区别棉织物和纯毛织物 | |
| D. | 氯气处理饮用水,在夏季的杀菌效果比在冬季好 |
14. 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
 一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )
一化学兴趣小组在家中进行化学实验,按照图1连接好线路发现灯泡不亮,按照图2连接好线路发现灯泡亮,由此得出的结论正确的是( )| A. | NaCl是非电解质 | |
| B. | NaCl溶液是电解质 | |
| C. | NaCl在水溶液中电离出了可以自由移动的离子 | |
| D. | 固体NaCl中没有离子 |
15.下列说法正确的是( )
| A. | 高纯硅广泛用于制作光导纤维 | |
| B. | 将SO2通入到BaCl2溶液中可生成白色沉淀 | |
| C. | 向AlCl3溶液中滴加氨水,产生白色沉淀,再加过量的NaHSO4溶液,沉淀消失 | |
| D. | CO、NO、NO2都是大气污染气体,在空气中都能稳定存在 |
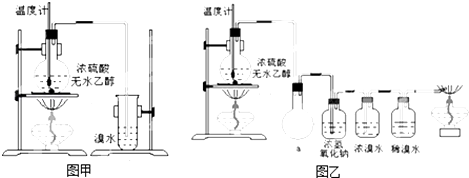
 CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.
CH2=CH2↑+H2O、CH2=CH2+Br2→CH2BrCH2Br.