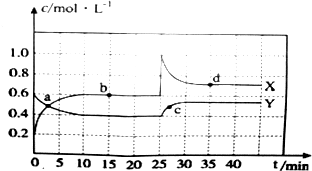
题目内容
9.已知A~F是中学化学中常见物质,其中A、C、E为气体,且A能使品红溶液褪色;B、D为液体,D的浓溶液在常温下能使铁钝化;F的浓溶液与X共热通常用于实验室制备单质C;X是一种黑色粉末,B分子中有18个电子.反应中部分生成物已略去.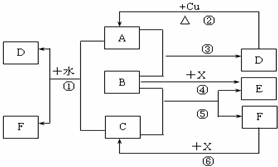
(1)写出反应②的化学方程式:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O.
(2)写出反应①、⑥的离子方程式:①Cl2+SO2+2H2O=4H++SO42-+2Cl-; ⑥MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O.
(3)根据图中信息,B、C、D、X氧化性从强到弱的顺序是MnO2>Cl2>H2O2>H2SO4(稀).
分析 D的浓溶液在常温下能使铁钝化,D能与Cu反应生成气体A能使品红溶液褪色,则D为H2SO4,A为SO2,B是液态,与二氧化硫反应得到硫酸,B具有强氧化性,且B分子中有18个电子,则B为H2O2,X是一种黑色粉末,与过氧化氢作用得到气体E,则X为MnO2,E为O2,F的浓溶液与X共热通常用于实验室制备单质C,B与C反应得到F与氧气,可知C为Cl2,F为HCl,氯气与二氧化硫在溶液中反应生成硫酸与HCl,据此解答.
解答 解:D的浓溶液在常温下能使铁钝化,D能与Cu反应生成气体A能使品红溶液褪色,则D为H2SO4,A为SO2,B是液态,与二氧化硫反应得到硫酸,B具有强氧化性,且B分子中有18个电子,则B为H2O2,X是一种黑色粉末,与过氧化氢作用得到气体E,则X为MnO2,E为O2,F的浓溶液与X共热通常用于实验室制备单质C,B与C反应得到F与氧气,可知C为Cl2,F为HCl,氯气与二氧化硫在溶液中反应生成硫酸与HCl.
(1)反应②的化学方程式:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O,
故答案为:Cu+2H2SO4(浓) $\frac{\underline{\;\;△\;\;}}{\;}$ CuSO4+SO2↑+2H2O;
(2)反应①的离子方程式:Cl2+SO2+2H2O=4H++SO42-+2Cl-,
反应⑥的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O,
故答案为:Cl2+SO2+2H2O=4H++SO42-+2Cl-;MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++Cl2↑+2H2O;
(3)氧化剂的氧化性强于氧化产物的影响,根据图中信息,B、C、D、X氧化性从强到弱的顺序是:MnO2>Cl2>H2O2>H2SO4(稀),
故答案为:MnO2>Cl2>H2O2>H2SO4(稀).
点评 本题考查无机物推断,物质的性质及D与Cu的反应为推断突破口,熟练掌握常见18电子微粒、元素化合物性质,较好的考查学生分析推理能力,难度中等.

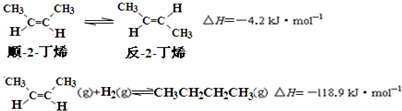
下列说法正确的是( )
| A. | 反-2-丁烯比顺-2-丁烯稳定 | |
| B. | 顺-2-丁烯的燃烧热数值比反-2-丁烯大 | |
| C. | 减压和升温有利于平衡向生成正丁烷反应方向移动 | |
| D. | 反-2-丁烯氢化的热化学方程式为: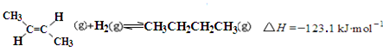 |
 葡萄可用于酿酒.
葡萄可用于酿酒.(1)检验葡萄汁含葡萄糖的方法是:向其中加碱调至碱性,再加入新制备的Cu(OH)2,加热,其现象是产生砖红色沉淀.
(2)葡萄在酿酒过程中,葡萄糖转化为酒精的化学方程式C6H12O6(葡萄糖)$\stackrel{酒化酶}{→}$2CO2↑+2C2H5OH.
(3)葡萄酒密封储存过程中生成了有香味的酯,酯也可以通过化学实验来制备.实验室用如图所示装置制备乙酸乙酯:
①试管a中生成乙酸乙酯的化学方程式是CH3COOH+C2H5OH
 CH3COOC2H5+H2O.
CH3COOC2H5+H2O.②试管b中盛放的试剂是饱和Na2CO3溶液.
③实验开始时,试管b中的导管不伸入液面下的原因是防止溶液倒吸.
(4)有机物E由碳、氢、氧三种元素组成,可由葡萄糖发酵得到,也可从酸牛奶中提取,纯净的E为无色粘稠液体,易溶于水.为研究E的组成与结构,进行了如下实验:
| ①称取E4.5g,升温使其汽化,测其密度是相同条件下H2的45倍. | ①有机物E的相对分子量为90: |
| ②将此9.0gE在足量纯O2充分燃烧,并使其产物依次通过碱石灰、无水硫酸铜粉末、足量石灰水,发现碱石灰增重14.2g,硫酸铜粉末没有变蓝,石灰水中有10.0g白色沉淀生成;向增重的碱石灰中加入足量盐酸后,产生4.48L无色无味气体(标准状况). | ②9.0g有机物E完全燃烧时,经计算:生成CO2共为0.3 mol, 生成的H2O5.4g. 有机物E的分子式C3H6O3 |
| ③经红外光谱测定,证实其中含有羟基,羧基,甲基; | ③E的结构简式CH3CH(OH)COOH |
⑤写出E与NaHCO3溶液反应的化学方程式HOOC-CH(OH)-CH3+NaHCO3→NaOOC-CH(OH)-CH3+H2O+CO2↑.
| A. | 石油的分馏和煤的干馏都是物理变化 | |
| B. | 甲烷、苯、乙醇都可以发生取代反应 | |
| C. | 淀粉和纤维素互为同分异构体 | |
| D. | 糖类都能发生水解反应 |
①
 ②
② ③
③
④C2H4 ⑤CH2═CH-CH═CH2 ⑥C3H6
⑦
 ⑧
⑧
| A. | ①和② | B. | ④和⑥ | C. | ⑤和⑥ | D. | ④和⑧ |
| 温度(绝对温度) | K1 | K2 |
| 973 | 1.47 | 2.38 |
| 1173 | 2.15 | 1.67 |
(2)通过K值的计算推断该反应是吸热 反应(填“吸热“或“放热“).
(3)在一体积为10L的密闭容器中,加入一定量的CO2和H2,在1173开时发生反应并记录前5min的浓度,第6min时改变了反应的条件.各物质的浓度变化如表:
| 时间/min | CO2 | H2 | CO | H2O |
| 0 | 0.2000 | 0.3000 | 0 | 0 |
| 2 | 0.1740 | 0.2740 | 0.0260 | 0.0260 |
| 3 | C1 | C2 | C3 | C3 |
| 4 | C1 | C2 | C3 | C3 |
| 5 | 0.0727 | 0.1727 | 0.1273 | 0.1273 |
| 6 | 0.0350 | 0.1350 | 0.1650 |
②在3~4min之间,反应处于平衡状态(填“平衡“或“非平衡“).
③第6min时,平衡向正反应 方向移动,可能的原因是升高温度或移走水蒸气.
 为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,
为维持人体血液中的血糖含量,在给病人输液时,通常用葡萄糖注射液.如图是医院病人输液使用的一瓶质量分数为6%的葡萄糖(C6H12O6相对分子质量为180)注射液标签,