题目内容
16.下列关于乙醇和乙酸的性质的叙述中,错误的是( )| A. | 金属Na与乙醇反应比与水反应更剧烈 | |
| B. | 在催化剂存在下,乙醇能被氧气氧化成乙醛 | |
| C. | 乙酸能与碳酸氢钠溶液反应放出CO2 | |
| D. | 在浓硫酸存在下加热,乙酸能与乙醇反应生成乙酸乙酯 |
分析 乙醇含有羟基,可与钠反应,可发生取代、氧化和消去反应,乙酸含有羧基,具有酸性,可发生中和、酯化反应,以此来解答.
解答 解:A.乙醇为非电解质,水为电解质,钠与水反应较剧烈,故A错误;
B.乙醇含有羟基,在催化条件下可发生氧化反应生成乙醛,故B正确;
C.乙酸酸性比碳酸强,可与碳酸氢钠溶液反应放出CO2,故C正确;
D.乙酸和乙醇在浓硫酸作用下发生取代反应可生成乙酸乙酯,也为酯化反应,故D正确.
故选A.
点评 本题考查有机物的结构与性质,为高频考点,把握官能团与性质的关系为解答的关键,侧重乙醇和乙酸性质的考查,题目难度不大.

练习册系列答案
相关题目
6.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述错误的是( )

| A. | 两个反应产生的气体不同 | |
| B. | Ⅱ比Ⅰ的反应速率快的原因是因为反应物浓度大 | |
| C. | 浓硝酸在常温下和不同金属反应的现象可能不同 | |
| D. | 浓硝酸与铜反应降价少,所以浓硝酸的氧化性弱 |
7.已知:H2CO3的酸性大于HClO,HClO的酸性大于HCO3-的酸性,判断在等浓度的NaClO、NaHCO3混合溶液中,各种离子浓度关系正确的是( )
| A. | c(HCO3-)>c(ClO-)>c(OH-) | B. | c(ClO-)>c(HCO3-)>c(H+) | ||
| C. | c(HClO)+c(ClO-)=c(HCO3-)+c(H2CO3) | D. | c(Na+)+c(H+)=c(HCO3-)+c(ClO-)+c(OH-) |
4.为鉴定某盐成分,选用如图方法:下列结论正确的是( )
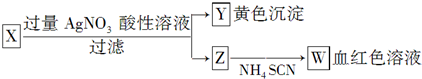

| A. | Z中一定有Fe3+ | B. | X中一定有Fe2+ | C. | Y为AgBr沉淀 | D. | X一定为FeBr2 |
11.为了检验某FeCl2溶液是否氧化变质,可向溶液中加入( )
| A. | NaOH 溶液 | B. | 铁片 | C. | 石蕊溶液 | D. | KSCN溶液 |
1.下列说法中,错误的是( )
| A. | 元素周期表中有7个主族,7个副族 | |
| B. | VIA族元素原子的最外层电子数均为6 | |
| C. | 碳元素位于第二周期ⅣA族 | |
| D. | 氢分子中的化学键是极性共价键 |
8.允许用一种试剂鉴别溴苯、苯和乙酸,最好选用( )
| A. | NaOH溶液 | B. | AgNO3溶液 | C. | 蒸馏水 | D. | 乙醇 |
6.下列各溶液中,微粒的物质的量浓度关系表述正确的是( )
| A. | 0.1 mol•L-1 Na2CO3溶液中:c(Na+)=c(HCO3-)+c(H2CO3)+2c(CO32-) | |
| B. | pH=12的Ba(OH)2溶液和pH=12的NaHCO3溶液中,水电离的c(H+)相等 | |
| C. | 将0.2 mol•L-1 NaA溶液和0.1 mol•L-1盐酸溶液等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(A-)+c(Cl-) | |
| D. | 常温下,pH=4的醋酸与pH=10的NaOH溶液等体积混合后c(OH-)<c(H+) |
 ;
;