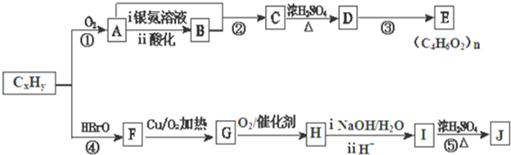
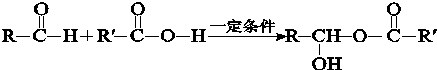
题目内容
6.将相同质量的铜分别和过量浓硝酸、稀硝酸反应,下列叙述错误的是( )
| A. | 两个反应产生的气体不同 | |
| B. | Ⅱ比Ⅰ的反应速率快的原因是因为反应物浓度大 | |
| C. | 浓硝酸在常温下和不同金属反应的现象可能不同 | |
| D. | 浓硝酸与铜反应降价少,所以浓硝酸的氧化性弱 |
分析 相同质量的铜分别和过量的浓硝酸、稀硝酸反应,3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O,结合硝酸的性质以及浓度对速率的影响分析.
解答 解:A.由3Cu+8HNO3═3Cu(NO3)2+2NO↑+4H2O、Cu+4HNO3═Cu(NO3)2+2NO2↑+2H2O可知,两个反应生成的气体不同,故A正确;
B.浓硝酸的浓度大于稀硝酸,浓度越大,反应速率越快,故B正确;
C.浓硝酸在常温下和不同金属反应的现象可能不同,如浓硝酸与Fe会钝化,浓硝酸与Cu反应生成气体,故C正确;
D.浓硝酸的氧化性大于稀硝酸,氧化性强弱与得电子能力有关,与得电子多少无关,故D错误;
故选:D.
点评 本题考查Cu与硝酸的反应,注意硝酸足量,Cu完全反应,把握发生的化学反应及氧化性强弱的比较方法即可解答,题目难度不大.

练习册系列答案
 快乐5加2金卷系列答案
快乐5加2金卷系列答案
相关题目
3.下列关于相对原子质量的说法正确的是( )
| A. | 是原子的实际质量 | B. | 是质子数加中子数 | ||
| C. | 标准是碳-12原子质量的$\frac{1}{12}$ | D. | 相对原子质量的单位是Kg |
20.下列离子方程式书写正确的是( )
| A. | 磁性氧化铁溶于稀硫酸:Fe2O3+6H+═2Fe3++3H2O | |
| B. | 氢氧化亚铁溶于稀硝酸:Fe(OH)2+2H+=Fe2++2H2O | |
| C. | 酸化的硫酸亚铁溶液中加入双氧水:Fe2++2H2O2═2Fe3++2H2O | |
| D. | 在氢氧化镁浑浊液中滴加氯化铁溶液:3Mg(OH)2+2Fe3+=3Mg2++2Fe(OH)3 |
1.某无色透明溶液中可能含有以下离子中的若干种K+、Mg2+、Al3+、Fe2+、Ba2+、NO3-、SO42-、CO32-、I-和Cl-,取该溶液进行如下实验:
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
①溶液滴在pH试纸上,呈红色
②将少许溶液加入铜片和硫酸,有无色气体产生,此气体与空气混合,立即变成红棕色
③取少许溶液滴入BaCl2溶液,则产生白色沉淀
④取实验③中的澄清溶液,滴入AgNO3溶液,产生不溶于稀HNO3的白色沉淀
⑤另取少许溶液,滴入NaOH溶液,有白色沉淀生成,当NaOH过量时,又有部分白色沉淀溶解.
根据以上现象判断原溶液中( )
| A. | ②中无色气体中有NO,可能含CO2 | |
| B. | ③中沉淀有BaSO4,可能含BaCO3 | |
| C. | 肯定存在的离子是Al3+、SO42-、NO3-、Mg2+,肯定不存在的离子是Ba2+、Fe2+、CO32-、I-,不能确定的离子是K+、Cl- | |
| D. | ②中红棕色气体通入水中发生反应的离子方程式为:3NO2+H2O═H++NO3-+2NO |
16.下列关于乙醇和乙酸的性质的叙述中,错误的是( )
| A. | 金属Na与乙醇反应比与水反应更剧烈 | |
| B. | 在催化剂存在下,乙醇能被氧气氧化成乙醛 | |
| C. | 乙酸能与碳酸氢钠溶液反应放出CO2 | |
| D. | 在浓硫酸存在下加热,乙酸能与乙醇反应生成乙酸乙酯 |

 .
.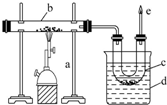 图是实验室干馏煤的装置图,回答下列问题:
图是实验室干馏煤的装置图,回答下列问题: