题目内容
13.废旧电池必须集中回收处理的首要原因是( )| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
分析 电池中含有的汞、镉、铜等重金属对土壤和水源具有污染性,据此解答.
解答 解:电池中含有的汞、镉、铜等重金属对土壤和水源都会产生污染,需要实行分类回收处理,故选B.
点评 本题考查了环境污染与治理,熟悉废电池中所含元素及对环境的影响是解题关键,题目难度不大.

练习册系列答案
相关题目
3.设NA为阿伏加德罗常数的值,下列说法正确的是( )
| A. | 在过氧化钠与水的反应中,每生成0.1mol氧气,转移的电子数目为0.4NA | |
| B. | 氢氧燃料电池正极消耗22.4L气体时,电路中通过的电子数目为4NA | |
| C. | 在30g二氧化硅晶体中含有的共价键数目为2NA | |
| D. | 将常温下含NA个NO2、N2O4分子的混合气体冷却至标准状况,其体积约为22.4L |
4.下列有关说法不正确的是( )
| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
1.下列与社会、生活有关的说法不正确的是( )
| A. | 绿色化学的核心是从源头上防止和消除化工生产对环境的污染 | |
| B. | 减少化石燃料的使用,有利于降低空气中pM2.5的数值 | |
| C. | “地沟油”禁止食用,但可以用来制柴油、肥皂等 | |
| D. | 淀粉、豆油、蛋白质都是天然高分子化合物 |
8.CN-可以造成水体污染,某小组采用如下方法对污水进行处理如图1.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
(5)若乙池中石墨(I)极产生无毒无害的物质,其电极反应式为2CN-+12OH--10e-=2CO32-+N2+6H2O
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.

I.双氧水氧化法除NaCN
(1)NaCN的电子式为
 ,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-
,用离子方程式表示NaCN溶液呈碱性的原因CN-+H2O?HCN+OH-(2)碱性条件下加入H202除CN-,可得到纯碱和一种无色无味的无毒气体,该反应的离子方程式为2CN-+5H2O2+2OH-=CO32-+N2↑+6H2O
Ⅱ.CN -和Cr2072-联合废水处理法
(3)②中反应后无气体放出,该反应的离子方程式为
(4)步骤③中,每处理0.4mol Cr2072-,至少消耗Na2S2O30.3mol.
Ⅲ,电化学法处理CN -如2图装置模拟电化学法处理CN -,有关结果见表.
| 实验 序号 | 电极 (X) | NaCI溶液浓度 (mol/L) | 甲中石墨表面通人气体 | 电流计读数 (A) |
| (1) | Fe | O.l | 空气 | I |
| (2) | Al | 0.1 | 空气 | 1.5Ⅰ |
| (3) | Fe | 0.1 | 02 | 2Ⅰ |
| (4) | Al | 0.5 | 空气 | 1.6Ⅰ |
(6)该实验表明电化学法处理CN -时,影响处理速率的因素有负极的金属材料、氧气的浓度.
18.下列说法中正确的是( )
| A. | 在AgCl悬浊液中加入KI溶液充分振荡:Ag++I-═AgI↓ | |
| B. | NH4+的水解反应离子方程式:NH4++H2O?NH3•H2O+H+ | |
| C. | 镀铜时,阳极的电极反应式为:Cu2++2e-═Cu | |
| D. | 某反应△H<0,则该反应在任意条件下均可自发进行 |
5.某主族元素R的最高正化合价与负化合价的代数和为4,由此可以判断( )
| A. | R元素的氢化物常温下可能为液态 | |
| B. | R一定是第ⅣA族元素 | |
| C. | R的气态氢化物化学式为H2R | |
| D. | R元素的气态氢化物比同周期其他元素的气态氢化物稳定 |
15.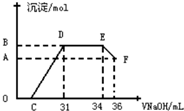 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
 研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )
研究发现,硝酸发生氧化还原反应时,硝酸的浓度越稀,对应还原产物中氮元素的化合价越低.某同学取一定量铁铝合金与一定量很稀的硝酸充分反应,反应过程中无气体放出.往反应结束后的溶液中,逐滴加入2mol•L-1的氢氧化钠溶液,所加氢氧化钠溶液的体积(mL)与产生的沉淀的物质的量(mol)的关系如图所示.下列选项正确的是( )| A. | 图中OC段的离子方程式为:NH4++OH-═NH3•H2O | |
| B. | 在DE段的离子方程式为:H++OH-═H2O | |
| C. | B与A的差值为 0.002mol | |
| D. | C点对应的氢氧化钠溶液的体积为7 mL |