题目内容
4.下列有关说法不正确的是( )| A. | 羊毛、棉花、淀粉都是自然界存在的天然高分子化合物 | |
| B. | 生物炼铜的原理是利用某些具有特殊本领的细菌把不溶性的硫化铜转化为铜单质 | |
| C. | 霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体,霾的形成与PM2.5有直接关系 | |
| D. | 一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低且极易被引燃,加热时最好用水浴加热 |
分析 A.相对分子质量在10000以上的有机化合物为高分子化合物,高分子化合物分为天然高分子化合物、合成高分子化合物;
B.微生物法是采用某些细菌能用空气中的氧气氧化硫化铜矿石;
C.霾是悬浮在大气中的大量微小尘粒、烟粒或盐粒的集合体;
D.沸点低加热易燃烧,水浴加热的温度较低.
解答 解:A.蛋白质、棉花、淀粉都相对分子质量在10000以上,属于天然高分子化合物,故A正确;
B.把不溶性的硫化铜氧化,硫从负二价被氧化成正六价,故最后转化成可溶的硫酸铜,故B错误;
C.霾是由悬浮在大气中的大量微小尘粒、烟粒等直径小于2.5μm的颗粒物形成的,这些污染物称为PM2.5,故C正确;
D.水浴加热的温度较低,则一些有机溶剂(如乙醚、乙醇、苯、丙酮等)沸点低极易被引燃,加热时最好用水浴加热,故D正确.
故选B.
点评 本题考查化学与环境、材料、信息、能源关系密切相关的知识,为高频考点,侧重于基础知识的综合理解和运用的考查,难度不大.

练习册系列答案
相关题目
19.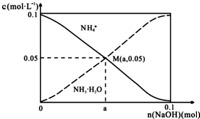 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
 常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )
常温下,向1L0.1mol•L-1NH4Cl溶液中,不断加入固体NaOH后,NH4+与NH3•H2O的变化趋势如图所示(不考虑体积变化和氨的挥发),下列说法正确的是( )| A. | M点溶液中水的电离程度比原溶液大 | |
| B. | 在M点时,n(OH-)-n(H+)=(a-0.05)mol | |
| C. | 随着NaOH的加入,$\frac{c({H}^{+})}{c(N{H}_{4}^{+})}$不断增大 | |
| D. | 当n(NaOH)=0.05mol时溶液中有:c(Cl-)>c(Na+)>c(NH4+)>c(OH-)>c(H+) |
9.CuCl 是难溶于水的白色固体,是一种重要的催化剂.工业上,由孔雀石(主要成分Cu(OH)2•CuCO3,含FeS、FeO 和SiO2杂质)制备CuCl 的某流程如下
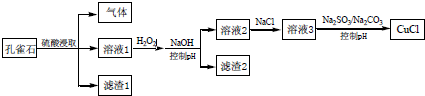
下列说法不正确的是( )

下列说法不正确的是( )
| A. | H2O2 将溶液1 中Fe2+氧化为Fe3+,再通过控制pH 转化为Fe(OH)3除去 | |
| B. | CO32-作用是控制溶液pH,促使CuCl 沉淀的生成 | |
| C. | SO32-将溶液3 中的Cu2+还原,反应得到CuCl | |
| D. | 若改变试剂加入顺序,将溶液3缓慢加入到含大量$\frac{S{O}_{3}^{2-}}{C{O}_{3}^{2-}}$的溶液中,同样可制取CuCl |
16.下列说法正确的是( )
| A. | 由反应SiO2+4HF═SiF4+2H2O,可知SiO2是碱性氧化物 | |
| B. | 由酸性溶液中MnO4-可以氧化Cl-,可知酸性溶液中MnO4-也能氧化Br- | |
| C. | 由反应CuSO4+H2S═CuS+H2SO4,可知酸性H2S>H2S04 | |
| D. | 由常温下金属钠、铝可溶于NaOH溶液,可知金属镁也能溶于NaOH溶液 |
13.废旧电池必须集中回收处理的首要原因是( )
| A. | 利用电池外壳的金属材料 | |
| B. | 防止电池中汞、镉和铅等重金属离子对土壤和水源的污染 | |
| C. | 不使电池中渗泄的电解液腐蚀其他物品 | |
| D. | 回收其中石墨电极 |
6.汽车尾气作为空气污染的主要来源之一,其中含有大量的有害物质,包括CO、NOx、碳氢化合物和固体悬浮颗粒等.对汽车尾气的治理使环境工作者面临了巨大的挑战.试回答下列问题:
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.
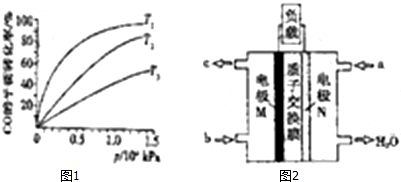
(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
该反应的正反应为放热反应(填“吸热”、“放热”),若起始是向容器Ⅰ中充入CH3OH0.15mol、CH3OCH30.15mol和H2O0.10mol,则反应将向正方向进行(填“正”、“逆”).
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
(1)用CH4催化还原NOx可以消除氮氧化物的污染.已知:
①CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g)△H=-1 160kJ•mol-1
②CH4(g)+4NO2(g)═4NO(g)+CO2(g)+2H2O(g)△H=-574kJ•mol-1
则由CH4将NO2完成还原成N2,生成CO2和水蒸气的热化学方程式是CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g)△H=-867kJ•mol-1;
(2)NOx也可被NaOH溶液吸收而生成NaNO3、NaNO2,已知某温度下,HNO2的电离常数Ka=9.7×10-4mol•L-1,
NO2-的水解常数为Kh=8.0×10-10mol•L-1,则该温度下水的离子积常数=Ka×Kh(用含Ka、Kh的代数式表示),此时溶液的温度>25℃(“>”、“<”、“=”).
(3)化工上利用CO合成甲醇,反应的热化学方程式为:CO(g)+2H2(g)═CH3OH(g)△H=-90.8KJ•mol-1.不同温度下,CO的平衡转化率如图1所示:图中T1、T2、T3的高低顺序是T1<T2<T3,理由是该反应为放热,温度越高,反应物的转化率越低.

(4)化工上还可以利用CH3OH生成CH3OCH3.在体积均为1.0L的恒容密闭容器中发生反应:2CH3OH(g)═CH3OCH3(g)+H2O(g).
| 容器编号 | 温度(℃) | 起始物质的量(mol) | 平衡物质的量(mol) | |
| CH3OH | CH3OCH3 | H2O | ||
| Ⅰ | 387 | 0.20 | 0.080 | 0.080 |
| Ⅱ | 207 | 0.20 | 0.090 | 0.090 |
(5)CH3OH燃料电池在便携式通讯设备、汽车等领域有着广泛的应用.已知电池工作时的总反应方程式为:2CH3OH+3O2=2CO2+4H2O,电池工作时的示意图如图2所示:质子穿过交换膜移向N电极区(填“M”、“N”),负极的电极反应式为CH3OH+H2O-6e-=CO2+6H+.
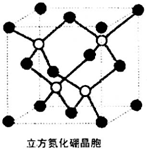 H2O和CS2分子中的原子都达到稳定结构.
H2O和CS2分子中的原子都达到稳定结构.