题目内容
12.认真观察下列装罝,回答下列问题: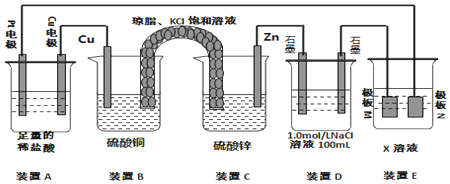
(1)装置B中Cu上发生的电极反应方程式为Cu2++2e-=Cu;电池工作时,对盐桥中的K+、Cl-的移动方向的表述正确的是A.
A.盐桥中的K+向左侧烧杯移动、Cl-向右侧烧杯移动
b.盐桥中的K+向右侧烧杯移动、Cl-向左侧烧杯移动
C.盐桥中的K+、Cl-都向左侧烧杯移动 D.盐桥中的K+、Cl-几乎都不移动
(2)装置A中总反应的离子方程式为Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑.
(3)若装置E的目的是在Cu材料上镀银,则X为AgNO3,极板N的材料为Ag;
(4)当装置A中Cu电极质量改变6.4g时,装置D中产生的气体体积为3.92L(标准状况下).
分析 (1)B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,盐桥中阴离子移向负极,阳离子移向正极;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,据此分析;
(3))电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,据此分析;
(4)当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl-2e-=Cl2↑、其次发生4OH-4e-=2H2O+O2↑,阴极只发生2H++2e-=H2↑,据此分析.
解答 解:(1)B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,电极反应式为:Cu2++2e-=Cu,盐桥中的K+、Cl-的移动方向为K+移向左侧正极,Cl-移向右侧负极,故答案为:Cu2++2e-=Cu;A;
(2)A连接电源,则A是电解池,左边Pt作阴极,右边Cu作阳极,阳极上Cu放电,阴极上氢离子放电,装置A中总反应的离子方程式为Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑,故答案为:Cu+2H+$\frac{\underline{\;电解\;}}{\;}$Cu2++H2↑;
(3)电镀时,镀层作阳极,镀件作阴极,电解质溶液中阳离子和镀层金属相同,若装置D的目的是在某镀件上镀银,则X为硝酸银溶液,N作阳极,应该是银,
故答案为:AgNO3;Ag;
(4)当装置A中Cu电极质量改变6.4g时,n(Cu)=0.1mol,则转移0.2mol电子,装置D中n(NaCl)=0.1mol,阳极首先发生2Cl-2e-=Cl2↑、其次发生4OH-4e-=2H2O+O2↑,则阳极首先生成0.05molCl2,其次生成0.025molO2,阴极只发生2H++2e-=H2↑,生成0.1molH2,则总共生成0.175mol气体,体积为0.175mol×22.4L/mol=3.92L,故答案为:3.92.
点评 本题考查了原电池和电解池原理,为高频考点,侧重于学生的分析能力和计算能力的考查,难点是电极反应式的书写.在图中确定原电池和电解池是解得本题的关键,B和C装置形成原电池,锌作负极,铜作正极,正极上铜离子得电子生成铜,盐桥中的K+、Cl-的移动方向为K+移向正极,Cl-移向负极.

(1)在一定条件下,在20L密闭容器中按物质的量比为1:3充入CO2和H2,温度在450K,n(H2)随时间变化如下表所示:
| t/min | 0 | 1 | 3 | 5 |
| N(H2)/mol | 8 | 6 | 5 | 5 |
(2)在5MPa下测得平衡体系中各物质的体积分数随温度的变化曲线如图所示:曲线乙表示的是CO2(填物质的化学式)的体积分数,图象中A点对应的体积分数b=18.8%(结果保留三位有效数字).
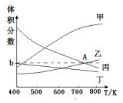
(3)下列措施中能使化学平衡向正反应方向移动的是BD
A.升高温度 B.将CH3CH2OH(g)及时液化抽出
C.选择高效催化剂 D.再充入l molCO2和3molH2
(4)25℃,1.01×105Pa时,9.2g液态乙醇完全燃烧,当恢复到原状态时,放出273.4kJ的热量,写出表示乙醇燃烧的热化学方程式:CH3CH2OH(l)+3O2(g)═CO2(g)+2H2O(l)△H=-1367kJ•mol-1.
(5)以石墨为电极,氢氧化钠、乙醇、水、氧气为原料,可以制成乙醇的燃料电池,写出发生还原反应的电极反应式:O2+2H2O+4e-═4OH?.
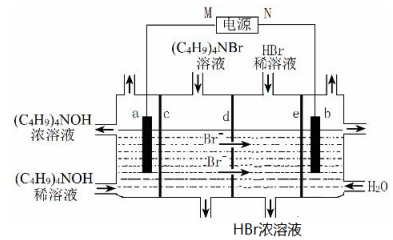
| A. | M为负极 | |
| B. | b极电极反应式:2H2O-4e-=O2↑+4H+ | |
| C. | c、e分别为阳离子交换膜和阴离子交换膜 | |
| D. | 制备 1mol(C4H9)4NOH,理论上 a极产生11.2L气体(标准状况下) |
| 时间 水样 | 0 | 5 | 10 | 15 | 20 | 25 |
| Ⅰ(pH=2) | 0.4 | 0.28 | 0.19 | 0.13 | 0.10 | 0.09 |
| Ⅱ(pH=4) | 0.4 | 0.31 | 0.24 | 0.20 | 0.18 | 0.16 |
| Ⅲ(pH=4) | 0.20 | 0.15 | 0.12 | 0.09 | 0.07 | 0.05 |
| Ⅳ(pH=4,含Ca2+) | 0.20 | 0.09 | 0.05 | 0.03 | 0.01 | 0 |
| A. | 在0~20 min内,Ⅰ中M的分解速率为0.015 mol•L-1•min-1 | |
| B. | 水样酸性越强,M的分解速率越快 | |
| C. | 在0~20 min内,Ⅲ中M的分解百分率比Ⅱ大 | |
| D. | 由于Ca2+存在,Ⅳ中M的分解速率比Ⅰ快 |
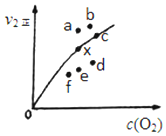
| A. | 使用催化剂可以提高该反应的焓变 | |
| B. | 增大O2的浓度可以提高反应速率和SO2的转化率 | |
| C. | 反应450℃时的平衡常数小于500℃时的平衡常数 | |
| D. | 2 mol SO2(g) 和1 mol O2(g)所含的总能量小于2 mol SO3(g) 所含的总能量 |
 利用化学反应原理研究氮和硫的化合物有重要意义.
利用化学反应原理研究氮和硫的化合物有重要意义.
 .
.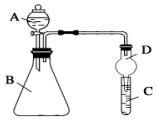 某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.
某同学为探究元素周期表中元素性质的递变规律,设计了如下系列实验.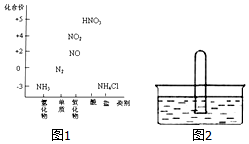 图1为氮及其化合物的类别与化合价对应的关系图.
图1为氮及其化合物的类别与化合价对应的关系图.