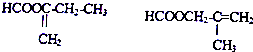题目内容
10.今有一混合物的水溶液,只可能含有以下离子中的若干种:Na+、NH4+、Ba2+、Cl-、CO32-、SO42-.现取两份200mL溶液进行如下实验:①第一份加足量NaOH溶液,加热,收集到气体1.36g;②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g.根据上述实验,以下推测正确的是( )| A. | 一定不存在Ba2+,NH4+可能存在 | B. | CO32-一定存在 | ||
| C. | Na+一定存在 | D. | 一定不存在Cl- |
分析 ①第一份加足量NaOH溶液,加热,收集到气体1.36g,气体为氨气,则含NH4+为$\frac{1.36g}{17g/mol}$=0.08mol;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,则含SO42-为$\frac{4.66g}{233g/mol}$=0.02mol,含CO32-为$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,则原溶液一定不含Ba2+,结合电荷守恒来解答.
解答 解:①第一份加足量NaOH溶液,加热,收集到气体1.36g,气体为氨气,则含NH4+为$\frac{1.36g}{17g/mol}$=0.08mol;
②第二份加足量BaCl2溶液后,得干燥沉淀12.54g,经足量盐酸洗涤、干燥后,沉淀质量为4.66g,则含SO42-为$\frac{4.66g}{233g/mol}$=0.02mol,含CO32-为$\frac{12.54g-4.66g}{197g/mol}$=0.04mol,则原溶液一定不含Ba2+,
由电荷守恒可知,0.08<0.02×2+0.04×2,则一定含Na+,不能确定是否含Cl-,
A.一定不存在Ba2+,一定存在NH4+,故A错误;
B.由12.54g及4.66g沉淀可知CO32-一定存在,故B正确;
C.由电荷守恒可知,Na+一定存在,故C正确;
D.上述实验不能确定是否含Cl-,故D错误;
故选BC.
点评 本题考查无机物的推断,为高频考点,把握物质的性质、发生的反应、白色沉淀的判断为解答的关键,侧重分析与推断能力的考查,注意电荷守恒的应用,题目难度不大.

练习册系列答案
相关题目
5.如图所示,a、b是两根石墨棒,下列叙述错误的是( )
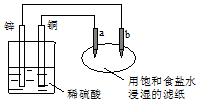

| A. | 往滤纸上滴加酚酞试液,a极附近颜色变红 | |
| B. | 锌电极上的反应:Zn-2e→Zn2+ | |
| C. | 稀硫酸中硫酸根离子的物质的量不变 | |
| D. | a是阳极,发生氧化反应 |
15.比较等体积等物质的量浓度的NaClO(aq)与NaCl(aq)中离子总数多少( )
| A. | 前者大 | B. | 后者大 | C. | 两者一样 | D. | 无法确定 |
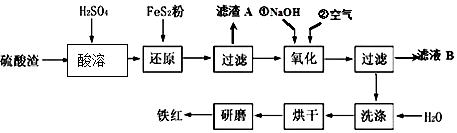
2. 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
 近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )
近年来发现用铈(Ce)的氧化物可高效制取H2,制备原理如图所示,已知0<δ<2,下列说法不正确的是( )| A. | 太阳能最终转变为化学能 | B. | CeO2是水分解的催化剂 | ||
| C. | T<1050℃时,CeO2-δ比CeO2稳定 | D. | 两步反应均属于氧化还原反应 |



 .
.

 扑热息痛的结构简式为
扑热息痛的结构简式为