题目内容
9.下列离子方程式与所述事实相符且正确的是( )| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
分析 A.硝酸具有氧化性,反应生成铁离子和水;
B.氢氧化钠过量,反应生成碳酸钙、碳酸钠和水;
C.氢氧化钠过量,铵根离子、碳酸氢根离子都反应;
D.离子个数配比不符合物质结构组成.
解答 解:A.将磁性氧化铁溶于足量稀硝酸中的离子反应为3Fe3O4+NO3-+28H+═9Fe3++14H2O+NO↑,故A错误;
B.Ca(HCO3)2溶液中加入过量NaOH溶液,离子方程式:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O,故B正确;
C.NH4HCO3溶于过量的NaOH溶液中,离子方程式:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故C错误;
D.氢氧化钡溶液与稀硫酸反应,离子方程式:Ba2++SO42-+2H++2OH-═BaSO4↓+2H2O,故D错误;
故选:B.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答本题的关键,注意氧化还原反应中电子守恒,题目难度不大.

练习册系列答案
相关题目
20.著名化学家徐光宪获得“国家最高科学技术奖”,以表彰他在稀土萃取理论方面作出的贡献.稀土铈(Ce)元素主要存在于独居石中,金属铈在空气中易氧化变暗,受热时燃烧,遇水很快反应.已知:铈常见的化合价为+3和+4,氧化性:Ce4+>Fe3+.下列说法不正确的是( )
| A. | 铈(Ce)元素在自然界中主要以化合态形式存在 | |
| B. | 铈溶于氢碘酸的化学方程式可表示为:Ce+4HI═CeI4+2H2↑ | |
| C. | 用Ce(SO4)2溶液滴定硫酸亚铁溶液,其离子方程式为:Ce4++Fe2+═Ce3++Fe3+ | |
| D. | 四种稳定的核素58136Ce、58138Ce、58140Ce、58142Ce,它们互称为同位素 |
17.现有500mL 0.2mol/L的BaCl2溶液,下列说法不正确的是( )
| A. | Cl-浓度为0.2 mol/L | |
| B. | 取出10 mL溶液中Ba2+浓度为0.2 mol/L | |
| C. | 溶液中Cl-总数为0.2NA | |
| D. | 取出50 mL溶液中Ba2+和Cl-总数为0.03NA |
4.下列有关浓硫酸性质及用途的说法不正确的是( )
| A. | 具有脱水性 | B. | 溶于水放出热量 | ||
| C. | 可用于干燥氨气 | D. | 常温下铁、铝在其中钝化 |
1.向密闭容器中充入1.0mol CO和2.0mol H2O(g)发生反应:CO(g)+H2O(g)?CO2(g)+H2(g).当反应达平衡时,CO的体积分数为α.若维持容器的体积和温度不变,起始物质按下列四种配比充入该容器中,达平衡时CO的体积分数小于α的是( )
| A. | 0.5 mol CO+2.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| B. | 1.0 mol CO+2.0 mol H2O(g)+0.5 mol He | |
| C. | 1.0 mol CO+1.0 mol H2O(g)+1.0 mol CO2+1.0 mol H2 | |
| D. | 0.5 mol CO+1.5 mol H2O(g)+0.4 mol CO2+0.4 mol H2 |
17.下列事实不能用电化学理论解释的是( )
| A. | 轮船水线以下的船壳上装上一定数量的锌块 | |
| B. | 银质奖章久置后表面变暗 | |
| C. | 黄铜(铜锌合金)制作的铜锣不易产生铜绿 | |
| D. | 纯锌与稀H2SO4反应滴入少量的CuSO4溶液后反应速率加快 |
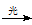 CH3Cl+HCl
CH3Cl+HCl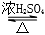 CH3COOCH2CH33+H2O
CH3COOCH2CH33+H2O 2CH3CHO+2H2O
2CH3CHO+2H2O