题目内容
14.已知16克A和20克B恰好完全反应生成0.05mol C和30克D,则C的摩尔质量为120 g•mol-1.分析 由质量守恒可知,C的质量为16g+20g-30g=6g,结合M=$\frac{m}{n}$计算;
解答 解:由质量守恒可知,C的质量为16g+20g-30g=6g,C的摩尔质量为$\frac{6g}{0.05mol}$=120g•mol-1,故答案为:120g•mol-1;
点评 本题考查物质的量的计算,为高频考点,把握质量、物质的量关系为解答的关键,侧重分析与计算能力的考查,注意质量守恒和摩尔质量的概念分析计算,题目难度不大.

练习册系列答案
相关题目
2.氯酸是一种强酸,浓度超过40%时会发生分解,反应可表示为:aHClO3=bO2↑+cCl2↑+dHClO4+eH2O.下列有关说法不正确的是( )
| A. | 由电子转移守恒和氯元素守恒可推出2b+a=6c | |
| B. | 若氯酸分解所得混合气体,在相同状态下密度是氢气的25.75信,则反应方程式可表示为:5HClO3=O2↑+Cl2↑+3HClO4+H2O | |
| C. | 由非金属性Cl>S,可推知酸性HClO4>H2SO4 | |
| D. | 若化学计量数a=3,b=2,则该反应转移电子数为10e- |
9.下列离子方程式与所述事实相符且正确的是( )
| A. | 磁性氧化铁溶于稀硝酸:Fe3O4+8H++NO3-═3Fe3++NO↑+4H2O | |
| B. | Ca(HCO3)2溶液中加入过量NaOH溶液:Ca2++2HCO3-+2OH-═CaCO3↓+CO32-+2H2O | |
| C. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-═CO32-+H2O | |
| D. | 氢氧化钡溶液与稀硫酸反应:Ba2++SO42-+H++OH-═BaSO4↓+H2O |
19.下列离子方程式中书写正确的是( )
| A. | NaHSO4在水溶液的电离方程式 NaHSO4?Na++H++SO42- | |
| B. | 氯化铵在氘水中的水解离子方程式 NH4++D2O?NH3•HDO+D+ | |
| C. | NaHS在水中的水解离子方程式 HS-+H2O?S2-+H3O+ | |
| D. | 碳酸钾固体在水中的水解离子方程式CO32-+2H2O?2OH-+H2CO3 |
6.用NA表示阿伏加德罗常数,下列叙述中正确的是( )
| A. | 标准状况下,22.4L乙醇完全燃烧后生成CO2的分子数为2NA | |
| B. | 56g的铁发生氧化还原反应,一定失去3NA个电子 | |
| C. | 标准状况下,22.4L氧气和二氧化碳混合气体中所含氧原子数为2NA | |
| D. | 0.1mol/L稀硫酸中含有SO42-离子数为0.1NA |
2.下列关于物质及其用途的关联中不正确的是( )
| A. | 乙醇-燃料 | B. | 蛋白质-生产葡萄糖 | ||
| C. | 淀粉-酿酒 | D. | 油脂-制造肥皂 |
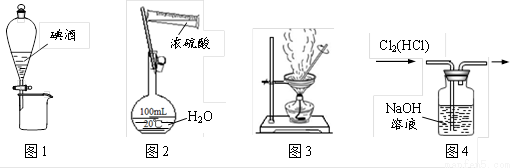
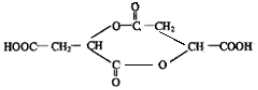 .
.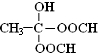 .(已知:
.(已知: )
) 2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )
2NH3的反应中,经过一段时间后,NH3的浓度增加了0.6mol/L,在此时间内,用H2表示的反应速率为0.45mol/(L·s),反应所经过的时间是( )