题目内容
18. a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:
a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l;b、d同主族,能形成两种中学常见的化合物;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质;e原子有四个能层,其未成对电子数在同周期是最多的.回答下列问题:(l)a在周期表中的位置第二周期VA族;e的基态原子价电子排布式为3d54s1.
(2)b、c、d原子的第一电离能由大到小的顺序是O>S>Al(用元素符号回答).
(3)a和b形成的离子W呈平面正三角形,其中心原子的杂化类型为sp2杂化;a、b、d气态氢化物最稳定的是H2O(写化学式).
(4)元素c与Fe构成合金的晶胞如图,该合金的化学式为AlFe2.
(5)将b、d组成的极性分子通入含少量W离子的BaCl2水溶液中,有NO气体生成.发生反应的离子方程式为3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+..
分析 a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l,若n=3,则a为Cl,b、c、d不能都处于短周期,不符合题意,则n=2,a为N元素;b、d同主族,能形成两种中学常见的化合物,则b为O元素、d为S元素;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质,则c为Al;e原子有四个能层,其未成对电子数在同周期是最多的,外围电子排布为3d54s1,则e为Cr.
解答 解:a、b、c、d是四种原子序数依次增大的短周期元素.a原子的电子层数为n,核内质子数是2n2-1,最外层电子数为2n+l,若n=3,则a为Cl,b、c、d不能都处于短周期,不符合题意,则n=2,a为N元素;b、d同主族,能形成两种中学常见的化合物,则b为O元素、d为S元素;c与b组成的化合物是一种两性氧化物,工业上通过电解该化合物可冶炼c单质,则c为Al;e原子有四个能层,其未成对电子数在同周期是最多的,外围电子排布为3d54s1,则e为Cr.
(l)a为N元素,在周期表中的位置:第二周期VA族;原子有四个能层,其未成对电子数在同周期是最多的,价电子电子排布式为3d54s1,
故答案为:第二周期VA族;3d54s1;
(2)同周期随原子序数增大,元素第一电离能呈增大趋势,同主族自上而下元素第一电离能减小,故原子的第一电离能由大到小的顺序是:O>S>Al,
故答案为:O>S>Al;
(3)a和b形成的离子W呈平面正三角形,中心原子杂化轨道数目为3,其中心原子的杂化类型为 sp2杂化,由于非金属性O>N、O>S,故氢化物中H2O最稳定,
故答案为:sp2杂化;H2O;
(4)晶胞中Al原子数目为8×$\frac{1}{8}$+6×$\frac{1}{2}$=4,晶胞中Fe原子数目为8,则该合金的化学式为AlFe2,
故答案为:AlFe2;
(5)a和b形成的离子W呈平面正三角形,则W为NO3-,b、d组成的极性分子为SO2,SO2通入含少量NO3-离子的BaCl2水溶液中,有NO气体生成.发生反应的离子方程式为:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+,
故答案为:3SO2+2NO3-+3Ba2-+2H2O=3BaSO4↓+2NO↑+4H+.
点评 本题是对物质结构与性质的考查,涉及核外电子排布、电离能、杂化方式与空间构型、晶胞计算、氧化还原反应等,熟练掌握元素化合物性质,掌握杂化方式与微粒空间构型关系.

 阅读快车系列答案
阅读快车系列答案 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
| A. | 以惰性材料为电极,KOH溶液为电解质构成原电池,负极反应式为H2-2e-=2H+ | |
| B. | 铜、锌在稀硫酸溶液中构成原电池,正极反应式为2H++2e-=H2↑ | |
| C. | 以铜为电极将2Fe3++Cu=2Fe2++Cu2+设计成原电池,正极反应式为Cu-2e-=Cu2+ | |
| D. | 以铝、铁为电极,在氢氧化钠溶液中构成原电池,负极反应式为Al-3e-=Al3+ |
| A. | 20 mL 12 mol/L的盐酸 | B. | 10 mL 18 mol/L的硫酸 | ||
| C. | 80 mL 2 mol/L的硫酸 | D. | 40 mL 14 mol/L的硝酸 |
| A. | ${\;}_{53}^{131}$I的化学性质与${\;}_{53}^{127}$I相同 | |
| B. | ${\;}_{53}^{131}$I的原子序数为53 | |
| C. | ${\;}_{53}^{131}$I的原子核外电子数为78 | |
| D. | ${\;}_{53}^{131}$I的原子核内中子数多于质子数 |
 系统命名:2,6二甲基辛烷;
系统命名:2,6二甲基辛烷; ;
; ;
;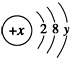 ( y≠0 ).请回答:
( y≠0 ).请回答:
 ;
;