题目内容
16.常温下,下列各组离子一定能在指定溶液中大量共存的是( )| A. | pH=12的溶液中:K+、Na+、AlO2-、CO32- | |
| B. | 在0.1mol•L-1的NaHCO3 溶液中:K+、Al3+、I-、Cl- | |
| C. | 与Al反应能放出H2的溶液中:Fe2+、K+、NO3-、SO42- | |
| D. | 使酚酞变红色的溶液中:Na+、Al3+、SO42-、Cl- |
分析 A.pH=12的溶液为碱性溶液,四种离子之间不反应,都不与碱性溶液中的氢氧根离子反应;
B.铝离子与碳酸氢钠发生双水解反应;
C.与Al反应能放出H2的溶液中存在大量氢离子或氢氧根离子,亚铁离子与氢氧根离子反应,硝酸根离子在酸性条件下氧化亚铁离子;
D.使酚酞变红色的溶液中存在大量氢氧根离子,铝离子与氢氧根离子反应.
解答 解:A.该溶液中存在大量氢氧根离子,K+、Na+、AlO2-、CO32-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故A正确;
B.Al3+与NaHCO3发生双水解反应,在溶液中不能大量共存,故B错误;
C.与Al反应能放出H2的溶液为酸性或强碱性溶液,Fe2+与氢氧根离子反应,Fe2+、NO3-在酸性条件下发生氧化还原反应,在溶液中不能大量共存,故C错误;
D.使酚酞变红色的溶液为碱性溶液,溶液中存在大量氢氧根离子,Al3+与氢氧根离子反应,在溶液中不能大量共存,故D错误;
故选A.
点评 本题考查离子共存的判断,为高考的高频题,属于中等难度的试题,注意明确离子不能大量共存的一般情况,如:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”;是“可能”共存,还是“一定”共存等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案 英才计划期末调研系列答案
英才计划期末调研系列答案
相关题目
6.下列有关实验原理或实验操作正确的是( )


| A. | 用水润湿的pH试纸测量某溶液的pH | |
| B. | 用量筒量取20 mL 0.5000 mol•L-1 H2SO4溶液于烧杯中,加水80 mL,配制成0.1000 mol•L-1 H2SO4溶液 | |
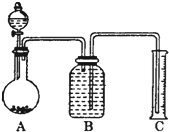
| C. | 实验室用图①所示装置制取少量氨气 | |
| D. | 实验室用图②所示装置除去Cl2中的少量HCl |
4.欲除去CuSO4•5H2O中的沙子,必要的实验操作为( )
| A. | 溶解 过滤 蒸发结晶 | B. | 加热 溶解 过滤 | ||
| C. | 溶解 过滤 蒸馏 | D. | 溶解 过滤 分液 |
1.短周期元素W、X、Y、Z在元素周期表中的位置如表所示.其中Z的单质是一种重要的半导体材料,广泛应用于电子工业的各个领域.
(1)W在元素周期表中的位置是第二周期第ⅣA族.
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
| W | X | ||
| Y | Z |
(2)r(Yn+)<r(Xm-).(填“>”“﹦”“<”)
(3)下列选项中,能证明元素非金属性X强于W的是CD.
A.原子序数:X>W B.最低化合价:X>W
C.最简单氢化物的稳定性:X>W D.最高价氧化物的水化物酸性:X>W
(4)元素周期表中与Z同周期的某金属元素形成的单质A,可发生如图所示的转化:

其中化合物D是一种白色沉淀,则A生成B的化学方程式为2Na+2NaOH+2H2O=2NaAlO2+3H2↑;B与C混合反应的离子方程式为Al3++3 AlO2-+6H2O=4Al(OH)3↓.
8. 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.
Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
(1)通过计算得出△H=-28kJ/mol.
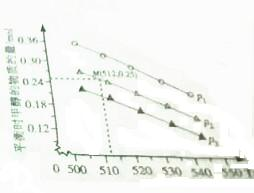
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
 环境问题已经是我国面临的重大问题.
环境问题已经是我国面临的重大问题.Ⅰ.减少二氧化碳的排放是一项重要客题.研究表明,CO2经催化加氢可合成低碳醇.
CO2(g)+3H2(g)?CH3OH(g)+H20(g)△H
几种化学键的键能知表所示
| 化学键 | C=O | H-H | C-C | C-H | O-H | C-O |
| 键能/kJ、mol-1 | 803 | 436 | 332 | 409 | 463 | 326 |
(2)在1.0L恒密闭容器中投入1molCO2和2.75molH2发生该反应,实验测得不同温度压强下,平衡时甲醇的物质的量如图所示.当压强为P2,温度为512K时,向该容器中投入1molCO2、0.5molH2、2molCH2OH、0.6molH2O,平衡向逆方向移动.
(3)以CH3OH、空气(O2含量20%)、KOH溶液为原料,以石墨为电极可直接构成燃料电池,则该电池的负极反应式为CH3OH+8OH--6e-=CO32-+6H2O,用该电池电解500mL1mol/LCuSO4溶液,当燃料电池消耗标况下56L空气时,计算理论上两极电解产生气体的总物质的量1mol.
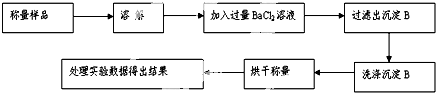
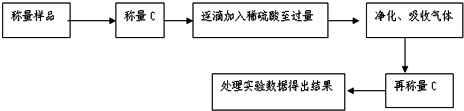

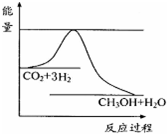 依据事实,写出下列反应的热化学方程式
依据事实,写出下列反应的热化学方程式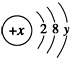 ( y≠0 ).请回答:
( y≠0 ).请回答: