题目内容
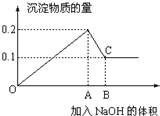 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:(1)图中C点表示加入
(2)c(MgCl2)=
(3)图中线段OA:AB=
考点:镁、铝的重要化合物,有关混合物反应的计算
专题:
分析:根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液.继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠时沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3],C点氢氧化铝完全溶解,根据铝元素守恒可知、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.前后两部分氢氧化钠之和为C加入的氢氧化钠;AB段沉淀物质的量最小为0.1mol,故氢氧化铝溶解于氢氧化钠溶液,据此书写方程式;
(2)根据c(MgCl2)=
进行计算;
(3)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3];AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3].
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3],C点氢氧化铝完全溶解,根据铝元素守恒可知、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.前后两部分氢氧化钠之和为C加入的氢氧化钠;AB段沉淀物质的量最小为0.1mol,故氢氧化铝溶解于氢氧化钠溶液,据此书写方程式;
(2)根据c(MgCl2)=
| n |
| V |
(3)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3];AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3].
解答:
解:根据图象可知,在滴加NaOH溶液到加入氢氧化钠为Amol时,沉淀量最大为0.2mol,说明氯化铝、氯化镁恰好完全反应,此时溶液为氯化钠溶液.继续滴加氢氧化钠,但在加入(B-A)mol时,沉淀物质的量最小为0.1mol,是氢氧化镁沉淀,所以加入Amol氢氧化钠是沉淀中有氢氧化镁0.1mol、氢氧化铝0.1mol;此时溶液为氯化钠、偏铝酸钠溶液.
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol,所以C点表示加入
=600ml;AB段发生的离子反应方程式为Al(OH)3+OH-═AlO2-+2H2O;故答案为:600;Al(OH)3+OH-═AlO2-+2H2O;
(2)根据以上分析,c(MgCl2)=
=
=1mol/L,故答案为:1;
(3)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol;AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3]=0.1mol,所以线段OA:AB=0.5mol:0.1mol=5:1.
故答案为:5:1
(1)根据氢氧根守恒可知,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol,C点氢氧化铝完全溶解,根据铝元素、钠元素守恒可知n(NaAlO2)=n[Al(OH)3]=0.1mol,所以溶解氢氧化铝加入的氢氧化钠为0.1mol.所以加入的氢氧化钠的物质的量为0.5mol+0.1mol=0.6mol,所以C点表示加入
| 0.6mol |
| 1mol/L |
(2)根据以上分析,c(MgCl2)=
| n |
| V |
| 0.1mol |
| 0.1L |
(3)OA表示滴加NaOH溶液是镁离子、铝离子完全沉淀是需要的氢氧化钠的物质的量,沉淀量最大时加入的氢氧化钠n(NaOH)=2n[Mg(OH)2]+3n[Al(OH)3]=2×0.1mol+3×0.1mol=0.5mol;AB表示溶解0.1mol氢氧化铝消耗的氢氧化钠的物质的量n(NaOH)=n[Al(OH)3]=0.1mol,所以线段OA:AB=0.5mol:0.1mol=5:1.
故答案为:5:1
点评:考查镁、铝化合物反应的混合计算,难度中等,关键是根据图象分析,明确每一段图象发生的化学反应、知道拐点代表的含义及溶液中溶质的成分,结合方程式对有关问题进行分析.注意守恒思想的运用,使计算简化.

练习册系列答案
相关题目
有一种酸式盐AHB,它的水溶液呈弱碱性.则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
| A、①② | B、③④ | C、②③ | D、①④ |
在托盘天平两端各放一只等质量的烧杯,向两只烧杯中分别注入相同质量、相同质量分数的稀硫酸,天平平衡.向左盘烧杯中加入镁,右盘烧杯中加入铁,反应完毕后,天平仍然平衡,则加入镁和铁的质量比可能是( )
| A、1:1 | B、3:7 |
| C、7:3 | D、81:77 |
假设SiO2晶体中Si原子被Al原子取代,不足的价数由K原子补充,当有
的Si原子被Al原子取代时可形成正长石,则正长石的化学组成为( )
| 1 |
| 4 |
| A、K2O?Al2O3?4SiO2 |
| B、K2O?Al2O3?6SiO2 |
| C、K2O?Al2O3?8SiO2 |
| D、K2O?Al2O3?2SiO2 |
下列说法正确的是( )
| A、向久置的氯水中滴入紫色石蕊试液,溶液将先变红后褪色 |
| B、欲除去Cl2中少量HCl气体,可将此混合气体通过盛饱和食盐水的洗气瓶 |
| C、漂白粉有效成分是CaCl2和Ca(ClO)2,应密闭保存 |
| D、SO2和Cl2都具有漂白作用,所以将两种气体同时作用于潮湿有色物质,可大大增强漂白作用 |
等物质的量的下列有机物完全燃烧,消耗氧气最少的是( )
| A、乙烯 | B、丙烯 | C、乙醇 | D、乙酸 |
下列有关铁及其化合物的说法中正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D、常温下,将铁钉投入浓硝酸中可生成Fe(NO3)2 |
下列有关叙述,正确的是( )
| A、加碘食盐能使淀粉溶液变蓝 |
| B、用电石和水反应制乙炔是氧化还原反应 |
| C、1mol乙酸与足量乙醇在浓硫酸催化下加热,可生成1 mol乙酸乙酯 |
| D、利用电石与水反应制取C2H2时,可采用CuSO4溶液除去杂质气体 |