题目内容
下列有关铁及其化合物的说法中正确的是( )
| A、赤铁矿的主要成分是Fe3O4 |
| B、铁与水蒸气在高温下的反应产物为Fe2O3和H2 |
| C、除去FeCl2溶液中的FeCl3杂质可以向溶液中加入铁粉,然后过滤 |
| D、常温下,将铁钉投入浓硝酸中可生成Fe(NO3)2 |
考点:铁的化学性质,铁的氧化物和氢氧化物
专题:元素及其化合物
分析:A.赤铁矿的主要成分是Fe2O3;
B.铁与水蒸气在高温下的反应产物为Fe3O4和H2;
C.因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁;
D.硝酸具有强氧化性,能将铁氧化为硝酸铁,常温下,金属铁遇到浓硝酸会钝化.
B.铁与水蒸气在高温下的反应产物为Fe3O4和H2;
C.因为铁离子能和铁反应生成亚铁离子,化学方程式为2FeCl3+Fe═3FeCl2,故可用铁除去FeCl2溶液中的少量氯化铁;
D.硝酸具有强氧化性,能将铁氧化为硝酸铁,常温下,金属铁遇到浓硝酸会钝化.
解答:
解:A、赤铁矿的主要成分是Fe2O3,故A错误;
B、铁与水蒸气在高温下的反应产物为Fe3O4和H2,故B错误;
C、铁粉把FeCl3还原成FeCl2,化学方程式为2FeCl3+Fe═3FeCl2,从而除去FeCl3,故C正确;
D、常温下,将铁钉投入浓硝酸中,会发生钝化,故D错误.
故选C.
B、铁与水蒸气在高温下的反应产物为Fe3O4和H2,故B错误;
C、铁粉把FeCl3还原成FeCl2,化学方程式为2FeCl3+Fe═3FeCl2,从而除去FeCl3,故C正确;
D、常温下,将铁钉投入浓硝酸中,会发生钝化,故D错误.
故选C.
点评:本题主要是基本知识的考查,可以根据所学知识进行回答,较简单,要求同学们加强对基础知识的储备.

练习册系列答案
相关题目
在室温下等体积的酸和碱的溶液混合后,pH一定小于7的是( )
| A、pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B、pH=3的盐酸跟pH=11的氨水 |
| C、0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D、pH=3的醋酸跟pH=11的氢氧化钡溶液 |
将Fe、Cu、Fe2+、Fe3+和Cu2+盛于同一容器中充分反应,如Fe有剩余,则容器中只能有( )
| A、Cu、Fe3+ |
| B、Fe2+、Fe3+ |
| C、Cu2+、Fe |
| D、Cu,Fe2+,Fe |
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①与②中c(H+)相同 |
| B、①与④混合,溶液中c(CH3COO-)=c(Na+) |
| C、②和③混合,所得混合溶液的pH大于7 |
| D、③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等 |
既能与稀硫酸反应,又能与NaOH溶液反应的是( )
| A、NaHCO3 |
| B、Al(OH)3 |
| C、(NH4)2SO4 |
| D、Fe2O3 |
下列操作方法或实验装置正确的是( )
A、 |
B、 |
C、 |
D、 |
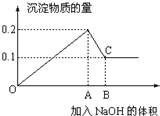 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则: