题目内容
有一种酸式盐AHB,它的水溶液呈弱碱性.则以下说法:
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
①相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度;
②H2B不是强酸;
③HB-的电离程度大于HB-的水解程度;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-=H++B2-;
其中错误的是( )
| A、①② | B、③④ | C、②③ | D、①④ |
考点:盐类水解的原理,弱电解质在水溶液中的电离平衡
专题:
分析:酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,或是一种强碱弱酸盐,根据水解原理以及电离情况来判断.
解答:
解:酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,或是一种强碱弱酸盐,
①若是强碱弱酸盐,则相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度,故正确;
②酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,或是一种强碱弱酸盐,H2B不是强酸,故正确;
③HB-的电离程度小于HB-的水解程度,故错误;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-?H++B2-,故错误.
故选B.
①若是强碱弱酸盐,则相同物质的量浓度的AOH溶液和H2B溶液,前者的电离程度大于后者的电离程度,故正确;
②酸式盐AHB,它的水溶液呈弱碱性,说明该盐中阴离子的水解程度大于电离程度,或是一种强碱弱酸盐,H2B不是强酸,故正确;
③HB-的电离程度小于HB-的水解程度,故错误;
④该盐溶液的电离方程式一般写成:AHB=A++HB-,HB-?H++B2-,故错误.
故选B.
点评:本题考查学生盐的水解原理以及电解质的电离知识,注意知识的归纳和梳理是解题的关键,难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
天然维生素P(结构如图)存在于槐树花蕾中,它是一种营养增补剂,关于维生素P的叙述错误的是( )
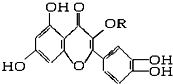

| A、可与溴水反应,且1 mol该物质与足量溴水反应耗6 mol Br2 |
| B、可与NaOH溶液反应,1 mol该物质可与4 mol NaOH反应 |
| C、一定条件下1 mol该物质可与H2加成,耗H2最大量为7 mol |
| D、维生素P遇FeCl3溶液发生显色反应 |
用标准浓度的盐酸滴定未知浓度的NaOH溶液,下列各操作(其他操作正确)中会造成测定结果偏低的是( )
| A、酸式滴定管尖嘴部分有气泡,滴定后消失 |
| B、滴定终点读数时俯视读数 |
| C、用蒸馏水洗净酸式滴定管后,装入标准盐酸进行滴定 |
| D、锥形瓶水洗后未干燥 |
在室温下等体积的酸和碱的溶液混合后,pH一定小于7的是( )
| A、pH=3的硝酸跟pH=11的氢氧化钾溶液 |
| B、pH=3的盐酸跟pH=11的氨水 |
| C、0.1mol/LCH3COOH与0.1mol/LNaOH溶液 |
| D、pH=3的醋酸跟pH=11的氢氧化钡溶液 |
下列溶液中,微粒的物质的量浓度关系一定正确的是( )
| A、0.1mol?L-1的硫化钾溶液中:c(OH-)>c(HS-)+2c(H2S) |
| B、常温下,pH=7的CH3COOH与CH3COONa的混合液中:c(CHC3OO-)<c(Na+) |
| C、0.1mol?L-1的NH4Cl溶液中:c(NH4+)>c(H+)>c(Cl-)>c(OH-) |
| D、pH=3的一元酸和pH=11的一元强碱等体积混合:c(H+)=c(OH-) |
区别乙醛、苯和溴苯,最简单的方法是( )
| A、加酸性KMnO4溶液后振荡 |
| B、加蒸馏水后振荡 |
| C、与新制Cu(OH)2共热 |
| D、加AgNO3溶液后振荡 |
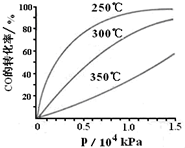 科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知:
科学家利用太阳能分解水生成氢气,再用氢气与二氧化碳在催化剂作用下反应生成甲醇,并开发出直接以甲醇为燃料的燃料电池.已知: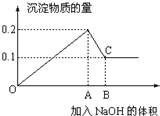 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则: