题目内容
假设SiO2晶体中Si原子被Al原子取代,不足的价数由K原子补充,当有
的Si原子被Al原子取代时可形成正长石,则正长石的化学组成为( )
| 1 |
| 4 |
| A、K2O?Al2O3?4SiO2 |
| B、K2O?Al2O3?6SiO2 |
| C、K2O?Al2O3?8SiO2 |
| D、K2O?Al2O3?2SiO2 |
考点:复杂化学式的确定
专题:计算题
分析:根据化学式化合价代数和为零,硅原子的总正价和铝原子的总正价和钾原子的总正价三者之和与氧原子的总负价代数和为零解答.设有nmol二氧化硅,含有nmolSi原子、2nmolO原子,然后根据当有25%的硅原子被铝原子取代,不足的价数由钾原子补充,计算出用n表示的铝原子、钾原子的物质的量,物质的量之比就等于原子个数比,从而得出正长石的化学式.
解答:
解:二氧化硅的化学式为SiO2,根据硅原子和氧原子守恒,则含有nmolSi原子、2nmolO原子,
根据题干信息可知:二氧化硅中有
的硅原子被铝原子取代,不足的由钾原子补充,设二氧化硅的物质的量为nmol,由于25%的硅原子被铝原子取代,所以Al原子的物质的量为:nmol×25%=0.25nmol,还剩余Si原子的物质的量为:0.75nmol,不足的价数由钾原子补充,根据化合价代数和为零,硅原子的总正价和铝原子的总正价和钾原子的总正价三者之和与氧原子的总负价代数和为零;n(K)×(+1)+n(Al)×(+3)+n(Si)×(+4)+n(O)×(-2)=0,n(K)×(+1)+0.25nmol×(+3)+0.75nmol×(+4)+2nmol×(-2)=0,则钾原子的物质的量为:n(K)=0.25nmol,所以正长石中各微粒的物质的量之比为:n(K):n(Al):n(Si):n(O)=0.25nmol:0.25nmol:0.75nmol:2nmol=1:1:3:8,
所以对应的化学式为KAlSi3O8,写为氧化物的形式同时扩大2倍,即为:K2O?Al2O3?6SiO2,
故选B.
根据题干信息可知:二氧化硅中有
| 1 |
| 4 |
所以对应的化学式为KAlSi3O8,写为氧化物的形式同时扩大2倍,即为:K2O?Al2O3?6SiO2,
故选B.
点评:本题考查了正长石的化学式的计算,解题关键是理解题干的信息,根据正长石的化学式化合价代数和为零进行解答,本题难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列溶液中,微粒的物质的量浓度关系一定正确的是( )
| A、0.1mol?L-1的硫化钾溶液中:c(OH-)>c(HS-)+2c(H2S) |
| B、常温下,pH=7的CH3COOH与CH3COONa的混合液中:c(CHC3OO-)<c(Na+) |
| C、0.1mol?L-1的NH4Cl溶液中:c(NH4+)>c(H+)>c(Cl-)>c(OH-) |
| D、pH=3的一元酸和pH=11的一元强碱等体积混合:c(H+)=c(OH-) |
区别乙醛、苯和溴苯,最简单的方法是( )
| A、加酸性KMnO4溶液后振荡 |
| B、加蒸馏水后振荡 |
| C、与新制Cu(OH)2共热 |
| D、加AgNO3溶液后振荡 |
下列物质中能使干燥的有色布条褪色的是( )
| A、氯水 | B、液氯 | C、氯气 | D、次氯酸 |
常温下有体积相同的四种溶液:①pH=3的CH3COOH溶液;②pH=3的HCl溶液;③pH=11的氨水;④pH=11的NaOH溶液.下列说法正确的是( )
| A、①与②中c(H+)相同 |
| B、①与④混合,溶液中c(CH3COO-)=c(Na+) |
| C、②和③混合,所得混合溶液的pH大于7 |
| D、③与④分别用等浓度的盐酸中和,消耗盐酸的体积相等 |
铅蓄电池的工作原理为:Pb+PbO2+2H2SO4═2PbSO4+2H2O,关于铅蓄电池的说法正确的是( )
| A、放电时正极发生的反应是:Pb(s)+SO42-(aq)-2e-═PbSO4(s) |
| B、放电时该电池的负极材料是铅板 |
| C、充电时,阳极发生的反应是PbSO4(s)+2e-═Pb(s)+SO42-(aq) |
| D、充电时,电池中硫酸的浓度不断增大 |
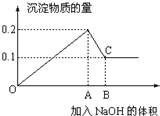 在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则:
在100mL MgCl2和AlCl3的混和溶液中,逐滴加入1mol/L NaOH溶液直至过量,经测定,加入NaOH的物质的量和所得沉淀的物质的量的关系如图所示,则: