题目内容
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族,下列说法正确的是( )
| A、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高氧化物对应的水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
考点:真题集萃,原子结构与元素周期律的关系
专题:元素周期律与元素周期表专题
分析:X原子的最外层电子数是其内层电子数的2倍,因此X是C,Y是地壳中含量最高的元素O,W与X同主族,W是Si,短周期元素Z2+与Y2-具有相同的电子层结构,电子层结构与Ne相同,因此Z为Mg,
A、同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
B、MgO中含有离子键,SiO2中含有共价键;
C、元素非金属性越强,最高价氧化物对应水化物的酸性越强,
D、元素非金属性越强,简单气态氢化物越稳定.
A、同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大;
B、MgO中含有离子键,SiO2中含有共价键;
C、元素非金属性越强,最高价氧化物对应水化物的酸性越强,
D、元素非金属性越强,简单气态氢化物越稳定.
解答:
解:X原子的最外层电子数是其内层电子数的2倍,因此X是C,Y是地壳中含量最高的元素O,W与X同主族,W是Si,短周期元素Z2+与Y2-具有相同的电子层结构,电子层结构与Ne相同,因此Z为Mg.
A、Mg和Si、C和O同周期,C和Si同主族,同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径r(Mg)>r(Si)>r(C)>r(O),故A错误;
B、Y分别与Z、W形成的化合物分别为MgO、SiO2,MgO中含有离子键,SiO2中含有共价键,化学键类型不同,故B错误;
C、C和Si同主族,非金属性C>Si,因此碳酸的酸性大于硅酸的酸性,故C错误;
D、非金属性O>Si,元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于SiH4,故D正确;
故选D.
A、Mg和Si、C和O同周期,C和Si同主族,同周期自左到右原子半径逐渐减小,同主族自上而下原子半径逐渐增大,因此原子半径r(Mg)>r(Si)>r(C)>r(O),故A错误;
B、Y分别与Z、W形成的化合物分别为MgO、SiO2,MgO中含有离子键,SiO2中含有共价键,化学键类型不同,故B错误;
C、C和Si同主族,非金属性C>Si,因此碳酸的酸性大于硅酸的酸性,故C错误;
D、非金属性O>Si,元素非金属性越强,简单气态氢化物越稳定,因此H2O的热稳定性大于SiH4,故D正确;
故选D.
点评:本题考查了短周期元素种类推断,涉及元素周期律中原子半径、非金属性的比较以及化合键的判定等知识,难度不大,熟悉短周期元素的原子结构、10个电子的微粒是解题的必备知识.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
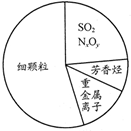 如图为雾霾的主要成分示意图.下列说法不正确的是( )
如图为雾霾的主要成分示意图.下列说法不正确的是( )| A、重金属离子可导致蛋白质变性 |
| B、苯是最简单的芳香烃 |
| C、SO2、NxOy都属于酸性氧化物 |
| D、利用丁达尔效应可检验雾霾是否为胶体 |
分子式为C9H12O,苯环上有两个取代基且含羟基的化合物,其可能的结构有( )
| A、9种 | B、12种 |
| C、15种 | D、16种 |
室温下,下列溶液中粒子浓度关系正确的是( )
| A、Na2S溶液:c(Na+)>c(HS-)>c(OH-)>c(H2S) |
| B、Na2C2O4溶液:c(OH-)=c(H+)+c(HC2O4-)+2c(H2C2O4) |
| C、Na2CO3溶液:c(Na+)+c(H+)=2c(CO32-)+c(OH-) |
| D、CH3COONa和CaCl2混合溶液:c(Na+)+c(Ca2+)=c(CH3COO-)+c(CH3COOH)+2c(Cl-) |
将a mol氢气和b mol乙烯混合,在一定条件下使它们部分反应生成c mol乙烷,将反应后的混合气体完全燃烧,消耗氧气的物质的量为( )
| A、(3b+0.5a)mol |
| B、(4b+0.5a)mol |
| C、(3b+1.5a)mol |
| D、无法判断 |
下列离子方程式中正确的是( )
| A、Cl2通入水中:Cl2+H2O?2H++Cl-+C1O- | ||||
| B、钢铁发生吸氧腐蚀时,铁作负极:Fe-3e-=Fe3+ | ||||
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | ||||
D、用铜作阳极电解CuSO4溶液:2Cu2++2H2O
|
 如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题:
如图为实验室某浓盐酸试剂瓶上的标签,试根据有关数据回答下列问题: