题目内容
下列离子方程式中正确的是( )
| A、Cl2通入水中:Cl2+H2O?2H++Cl-+C1O- | ||||
| B、钢铁发生吸氧腐蚀时,铁作负极:Fe-3e-=Fe3+ | ||||
| C、向双氧水中加入稀硫酸和KI溶液:H2O2+2H++2I-=I2+2H2O | ||||
D、用铜作阳极电解CuSO4溶液:2Cu2++2H2O
|
考点:离子方程式的书写
专题:离子反应专题
分析:A.HClO在离子反应中保留化学式;
B.Fe失去2个电子;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.铜作阳极电解CuSO4溶液,发生电镀原理.
B.Fe失去2个电子;
C.发生氧化还原反应,遵循电子、电荷守恒;
D.铜作阳极电解CuSO4溶液,发生电镀原理.
解答:
解:A.Cl2通入水中的离子反应为Cl2+H2O?H++Cl-+HC1O,故A错误;
B.钢铁发生吸氧腐蚀时,铁作负极的电极反应为Fe-2e-=Fe2+,故B错误;
C.向双氧水中加入稀硫酸和KI溶液的离子反应为H2O2+2H++2I-=I2+2H2O,故C正确;
D.用铜作阳极电解CuSO4溶液,阳极发生Cu-2e-=Cu2+,阴极发生Cu2++2e-=Cu,故D错误;
故选C.
B.钢铁发生吸氧腐蚀时,铁作负极的电极反应为Fe-2e-=Fe2+,故B错误;
C.向双氧水中加入稀硫酸和KI溶液的离子反应为H2O2+2H++2I-=I2+2H2O,故C正确;
D.用铜作阳极电解CuSO4溶液,阳极发生Cu-2e-=Cu2+,阴极发生Cu2++2e-=Cu,故D错误;
故选C.
点评:本题考查离子反应的书写,为高频考点,把握发生的化学反应及离子反应的书写方法为解答的关键,涉及电极反应、氧化还原反应的离子反应书写,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族,下列说法正确的是( )
| A、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高氧化物对应的水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
在探究新制饱和氯水成分的实验中,下列根据实验现象得出的结论不正确的是( )
| A、氯水的颜色呈浅黄绿色,说明氯水中含有Cl2 |
| B、向氯水中滴加硝酸酸化的AgNO3溶液,产生白色沉淀,说明氯水中含有Cl- |
| C、向氯水中加入NaHCO3粉末,有气泡产生,说明氯水中含有H+ |
| D、向FeCl2溶液中滴加氯水,溶液颜色变成棕黄色,说明氯水中含有HClO |
常温下,下列指定条件下能大量共存的微粒是( )
| A、乙醇稀溶液:K+、Na+、SO42-、OH- | ||
| B、氨水溶液:Mg2+、Ag+、NO3-、CH3COOH | ||
C、
| ||
| D、使石蕊变红的溶液:Fe2+、Al3+、ClO-、CO32- |
下列实验能达到目的是( )
| A、只滴加氨水鉴别NaCl、AlCl3、MgCl2、Na2SO4四种溶液 |
| B、将NH4Cl溶液蒸干制备NH4Cl固体 |
| C、用萃取分液的方法除去酒精中的水 |
| D、用可见光束照射以区别溶液和胶体 |
元素周期律揭示元素间的递变规律,既有相似性又有递变性,下列递变规律正确的是( )
| A、第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性的顺序也是:HCl>H2S |
| B、IVA族元素氢化物熔点顺序是:SiH4>CH4,所以VA族元素氢化物熔点顺序也是:PH3>NH3 |
| C、ⅦA族元素的非金属性是:F>Cl,所以ⅦA族元素氢化物的酸性也是:HF>HCl |
| D、镁比铝活泼,工业上用电解熔融氧化铝制备铝,所以工业上也用电解熔融氧化镁制备镁 |
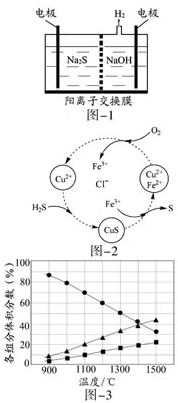 硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.