题目内容
某无色透明溶液可能存在Na+、Fe3+、Ba2+、NO3-、CO32-、HCO3-、SO42-中的几种离子,现有如下操作:
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体.
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成.
试回答下列问题:
(1)该溶液中一定存在的离子有 ,一定不存在的离子 .
(2)用一个离子方程式表示操作②的实验现象: .
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,继续滴加盐酸产生无色无味的气体.
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成.
试回答下列问题:
(1)该溶液中一定存在的离子有
(2)用一个离子方程式表示操作②的实验现象:
考点:常见离子的检验方法,离子共存问题
专题:离子反应专题
分析:无色溶液中不存在有色离子,Fe3+为浅黄色;
Ⅰ、硫酸钙微溶,碳酸钙难溶,则溶液中一定不存在SO42-、CO32-;产生的气体为二氧化碳气体,说明溶液中一定存在碳酸氢根离子;
Ⅱ、加入氢氧化钠溶液后发生反应:HCO3-+OH-=CO32-+H2O,碳酸根离子和钡离子结合生成沉淀,说明溶液中一定存在钡离子和碳酸氢根离子,据此进行解答.
Ⅰ、硫酸钙微溶,碳酸钙难溶,则溶液中一定不存在SO42-、CO32-;产生的气体为二氧化碳气体,说明溶液中一定存在碳酸氢根离子;
Ⅱ、加入氢氧化钠溶液后发生反应:HCO3-+OH-=CO32-+H2O,碳酸根离子和钡离子结合生成沉淀,说明溶液中一定存在钡离子和碳酸氢根离子,据此进行解答.
解答:
解:Fe3+为浅黄色,无色透明溶液中一定不含有Fe3+;
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,因硫酸钙微溶,碳酸钙难溶,说明原溶液中不含有SO42-、CO32-;继续滴加盐酸产生无色无味的气体,H++HCO3-=H2O+CO2↑,所以,该溶液中一定存在HCO3-;
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成,是由于NaOH电离出氢氧根离子和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子结合生成沉淀,Ba2++HCO3-+OH-=BaCO3↓+H2O,
(1)根据以上分析可知,该溶液中一定存在的离子有:Ba2+、HCO3-;一定不存在的离子为:Fe3+、CO32-、SO42-,
故答案为:Ba2+、HCO3-;Fe3+、CO32-、SO42-;
(2)反应②生成的白色沉淀为碳酸钡,反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O(或Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O),
故答案为:Ba2++HCO3-+OH-=BaCO3↓+H2O(或Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O).
Ⅰ、取适量该溶液加入CaCl2溶液无沉淀,因硫酸钙微溶,碳酸钙难溶,说明原溶液中不含有SO42-、CO32-;继续滴加盐酸产生无色无味的气体,H++HCO3-=H2O+CO2↑,所以,该溶液中一定存在HCO3-;
Ⅱ、另取该溶液滴加一定量的NaOH溶液有白色沉淀生成,是由于NaOH电离出氢氧根离子和碳酸氢根离子反应生成碳酸根离子,碳酸根离子和钡离子结合生成沉淀,Ba2++HCO3-+OH-=BaCO3↓+H2O,
(1)根据以上分析可知,该溶液中一定存在的离子有:Ba2+、HCO3-;一定不存在的离子为:Fe3+、CO32-、SO42-,
故答案为:Ba2+、HCO3-;Fe3+、CO32-、SO42-;
(2)反应②生成的白色沉淀为碳酸钡,反应的离子方程式为:Ba2++HCO3-+OH-=BaCO3↓+H2O(或Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O),
故答案为:Ba2++HCO3-+OH-=BaCO3↓+H2O(或Ba2++2HCO3-+2OH-=BaCO3↓+CO32-+2H2O).
点评:本题考查常见离子的检验、离子方程式的书写,题目难度中等,注意把握离子的性质以及检验方法,要求学生能够根据题干信息及反应现象判断离子的存在情况.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
短周期主族元素X、Y、Z、W的原子序数依次增大,X原子的最外层电子数是其内层电子数的2倍,Y是地壳中含量最高的元素,Z2+与Y2-具有相同的电子层结构,W与X同主族,下列说法正确的是( )
| A、原子半径的大小顺序:r(W)>r(Z)>r(Y)>r(X) |
| B、Y分别与Z、W形成的化合物中化学键类型相同 |
| C、X的最高氧化物对应的水化物的酸性比W的弱 |
| D、Y的气态简单氢化物的热稳定性比W的强 |
元素周期律揭示元素间的递变规律,既有相似性又有递变性,下列递变规律正确的是( )
| A、第二周期元素氢化物稳定性的顺序是:HF>H2O,所以第三周期元素氢化物稳定性的顺序也是:HCl>H2S |
| B、IVA族元素氢化物熔点顺序是:SiH4>CH4,所以VA族元素氢化物熔点顺序也是:PH3>NH3 |
| C、ⅦA族元素的非金属性是:F>Cl,所以ⅦA族元素氢化物的酸性也是:HF>HCl |
| D、镁比铝活泼,工业上用电解熔融氧化铝制备铝,所以工业上也用电解熔融氧化镁制备镁 |
常温下,向0.1mol/L CH3COOH溶液中加入CH3COONa晶体或加水稀释时,都会引起( )
A、溶液中
| ||
| B、溶液中c(H+)增大 | ||
| C、溶液的导电能力减小 | ||
| D、CH3COOH的电离程度增大 |
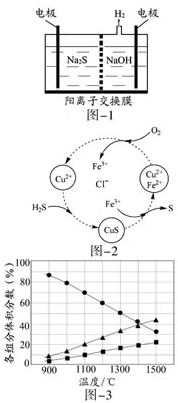 硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
硫化氢的转化是资源利用和环境保护的重要研究课题,由硫化氢获得硫单质有多种方法.
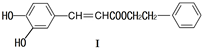

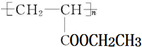 可用于制备涂料,其单体结构简式为
可用于制备涂料,其单体结构简式为