题目内容
13.为探究碳酸氢钠的热稳定性,并验证其产物与过氧化钠的反应,按以下装置图进行实验,填写有关现象及化学方程式.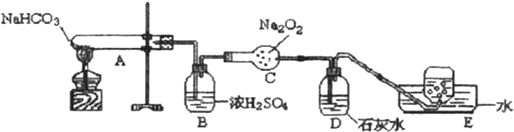
(1)写出A中发生反应的化学方程式为2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O
(2)B中浓硫酸的作用是干燥二氧化碳
(3)C中发生反应的化学方程式为2Na2O2+2CO2=Na2CO3+O2,每反应1molNa2O2转移1mol电子
(4)E中收集的气体是O2.
分析 实验目的是探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,由实验装置可知,A中碳酸氢钠分解生成二氧化碳,B中浓硫酸干燥气体,C中发生2Na2O2+2CO2=Na2CO3+O2,D中吸收二氧化碳,E为排水法收集氧气,以此来解答.
解答 解:探究碳酸氢钠的热稳定性,并利用其产物验证过氧化钠与二氧化碳的反应,由实验装置可知,A中碳酸氢钠分解生成二氧化碳,B中浓硫酸干燥气体,C中发生2Na2O2+2CO2=Na2CO3+O2,D中吸收二氧化碳,E为排水法收集氧气,
(1)A中碳酸氢钠加热分解生成碳酸钠、二氧化碳气体和水,反应的化学方程式为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O,
故答案为:2NaHCO3$\frac{\underline{\;\;△\;\;}}{\;}$Na2CO3+CO2↑+H2O;
(2)B中浓硫酸的作用是干燥二氧化碳,
故答案为:干燥二氧化碳;
(3)C中发生反应的化学方程式为2Na2O2+2CO2=Na2CO3+O2,由O元素的化合价从-1价升高为0可知,每反应1molNa2O2转移1mol电子,
故答案为:2Na2O2+2CO2=Na2CO3+O2;1;
(4)E中收集的气体主要是O2,
故答案为:O2.
点评 本题考查碳酸氢钠的性质,为高频考点,题目难度中等,明确实验目的为解答关键,注意掌握碳酸氢钠与过氧化钠的性质,试题侧重对学生的分析能力及化学实验能力的考查.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
4.稀氨水中存在着下列平衡:NH3•H2O?NH4++OH-,若要使平衡向逆反应方向移动,同时使c(OH-)增大,应加入的物质或采取的措施是( )
①NH4Cl固体 ②硫酸 ③NaOH固体④水 ⑤加热⑥加入少量MgSO4固体.
①NH4Cl固体 ②硫酸 ③NaOH固体④水 ⑤加热⑥加入少量MgSO4固体.
| A. | ①②③⑤ | B. | ③⑥ | C. | ③ | D. | ③⑤ |
18.下列同周期元素中,原子半径最小的是( )
| A. | Mg | B. | Al | C. | Si | D. | S |
5.下列有关物质性质的比较,不正确的是( )
| A. | 金属性:Al>Mg | B. | 稳定性:HF>HCl | ||
| C. | 酸性:HClO4>H2SO4 | D. | 碱性:NaOH>Mg(OH)2 |
3.油酸的结构简式是( )
| A. | CH2=CHCOOH | B. | C15H31COOH | C. | C17H33COOH | D. | C17H35COOH |
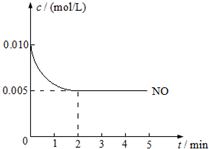 2NO(g)+O2(g)?2NO2(g)△H<0是制造硝酸的重要反应之一.在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如图所示:
2NO(g)+O2(g)?2NO2(g)△H<0是制造硝酸的重要反应之一.在800℃时,向容积为1L的密闭容器中充入0.010mol NO和0.005molO2,反应过程中NO的浓度随时间变化如图所示: