题目内容
5.下列有关物质性质的比较,不正确的是( )| A. | 金属性:Al>Mg | B. | 稳定性:HF>HCl | ||
| C. | 酸性:HClO4>H2SO4 | D. | 碱性:NaOH>Mg(OH)2 |
分析 A、根据金属活动性顺序表来判断
B、同一主族元素的原子,从下到上,元素的非金属性逐渐增强,元素的非金属性越强,气态氢化物稳定性越强;
C、同一周期,原子序数越大,非金属性越强,故其最高价氧化物对应的水化物的酸性越强;
D、元素的金属性越强,其对应碱的碱性越强.
解答 解:A、由金属活动性顺序表可知:金属性:Mg>Al,且两者处于同一周期,原子序数依次增大,原子序数小的,金属性强,故A错误;
B、由于非金属性F>Cl,故稳定性HF>HCl,故B正确;
C、由于非金属性Cl>S,故酸性HClO4>H2SO4.故C正确;
D、元素的金属性越强,其最高价氧化物对应的碱的碱性越强,由于金属性Na>Mg,故碱性NaOH>Mg(OH)2,故D正确;故选A.
点评 本题主要考查的是学生对元素周期律的应用知识,掌握金属性以及非金属性的递变规律是解决本题的关键,难度不大.

练习册系列答案
相关题目
16.下列各组顺序,正确的是( )
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3>H2O>HF | |
| C. | 密度大小:Rb>K>Na>Li | |
| D. | 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3 |
20.羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫的危害.在恒容密闭容器中,CO和H2S混合加热生成羰基硫的反应为 CO(g)+H2S(g)?COS(g)+H2(g).下列说法能充分说明该反应已经达到化学平衡状态的是( )
| A. | 正、逆反应速率都等于零 | B. | CO、H2S、COS、H2的浓度相等 | ||
| C. | CO、H2S、COS、H2在容器中共存 | D. | CO、H2S、COS、H2的浓度均不再变化 |
14.绚丽的焰火将上海世博会开幕式推向了高潮.焰火与高中化学中“焰色反应”知识有关.下列有关“焰色反应”说法中正确的是( )
| A. | 做焰色反应实验时,应用H2SO4清洗铂丝 | |
| B. | 焰色反应是单质特有的性质 | |
| C. | 碳酸钾在酒精灯上灼烧时能直接观察到紫色火焰 | |
| D. | NaCl与Na2SO4灼烧时火焰颜色均为黄色 |
 在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.
在一定温度下,向1L体积固定的密闭容器中加入1molA(g),发生反应2A(g)?B(g)+C(g),B的物质的量随时间的变化如图所示. 0-2min内的平均反应速率v(A)=0.1mol/(L•min).相同温度下,若开始加入A(g)的物质的量是原来的2倍,则平衡时be是原来的2倍.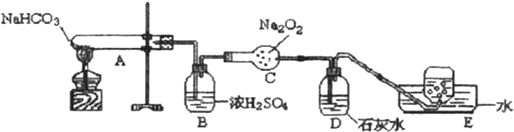
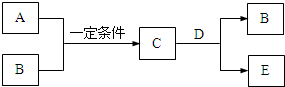 A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:
A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图: