题目内容
8.(1)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液5mL,溶液中的溶质为CH3COOH、CH3COONa,pH<7(填“>”、“<”或“=”),此时溶液中各离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-).上述溶液中存在的两个等量关系分别是c(CH3COO-)+c(CH3COOH)=2c(Na+)(物料守恒),c(CH3COO-)+c(OH-)=c(Na+)+c(H+)(电荷守恒).
(2)向10mL0.10mol/LCH3COOH溶液滴加一定量的0.10mol/LNaOH溶液,使溶液恰好为中性,溶液中的溶质为CH3COOH,CH3COONa,PH=7(填“>”、“<”或“=”),此时溶液中离子浓度大小关系为c(CH3COO-)=c(Na+)>c(H+)=c(OH-),所加NaOH溶液的体积V<10mL(填“>”、“<”或“=”).
(3)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液10mL,溶液中的溶质为CH3COONa,PH>7(填“>”、“<”或“=”),溶液中各离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+).
(4)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液20mL,溶液中的溶质为CH3COONa、NaOH,PH>7(填“>”、“<”或“=”),溶液中各离子浓度大小关系为c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
分析 (1)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液5mL,反应生成CH3COONa,溶液中为等物质的量的醋酸钠和醋酸;醋酸过量,溶液显酸性;根据电荷守恒和物料守恒分析;
(2)CH3COOH与NaOH恰好反应生成CH3COONa,溶液显碱性,若显中性,则醋酸稍微过量;结合电荷守恒分析;
(3)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液10mL恰好反应生成CH3COONa,溶液显碱性,醋酸根离子发生水解,浓度会减小;
(4)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液20mL,NaOH过量,反应后溶质为等物质的量的CH3COONa和NaOH;溶液显碱性,由于醋酸根用能水解,所以氢氧根离子浓度大于醋酸根的浓度.
解答 解:(1)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液5mL,反应生成CH3COONa,溶液中为等物质的量的醋酸钠和醋酸;醋酸过量,溶液显酸性,则pH<7;此时溶液中各离子浓度大小关系为c(CH3COO-)>c(Na+)>c(H+)>c(OH-);醋酸与醋酸根离子的总浓度是钠离子浓度的2被,则溶液中物料守恒为:c(CH3COO-)+c(CH3COOH)=2c(Na+);溶液中阳离子所带正电荷的总浓度等于阴离子所带负电荷的总浓度,即电荷守恒为:c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
故答案为:CH3COOH、CH3COONa;<;c(CH3COO-)>c(Na+)>c(H+)>c(OH-);c(CH3COO-)+c(CH3COOH)=2c(Na+);c(CH3COO-)+c(OH-)=c(Na+)+c(H+);
(2)CH3COOH与NaOH恰好反应生成CH3COONa,溶液显碱性,若显中性,则醋酸稍微过量,则混合后的溶质为CH3COOH,CH3COONa;溶液显中性,则pH=7;溶液中c(H+)=c(OH-),由电荷守恒c(CH3COO-)+c(OH-)=c(Na+)+c(H+)可知c(CH3COO-)=c(Na+),则离子浓度大小关系为:c(CH3COO-)=c(Na+)>c(H+)=c(OH-);醋酸稍微过量,则所加NaOH溶液的体积V<10mL;
故答案为:CH3COOH,CH3COONa;=;c(CH3COO-)=c(Na+)>c(H+)=c(OH-)<;
(3)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液10mL恰好反应生成CH3COONa,溶液显碱性,则pH>7;醋酸根离子发生水解,浓度会减小,所以溶液中各离子浓度大小关系为c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
故答案为:CH3COONa;>;c(Na+)>c(CH3COO-)>c(OH-)>c(H+);
(4)向10mL0.10mol/LCH3COOH溶液滴加0.10mol/LNaOH溶液20mL,NaOH过量,反应后溶质为等物质的量的CH3COONa和NaOH;溶液显碱性,即pH>7,由于醋酸根用能水解,所以氢氧根离子浓度大于醋酸根的浓度,则溶液中各离子浓度大小关系为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);
故答案为:CH3COONa和NaOH;>;c(Na+)>c(OH-)>c(CH3COO-)>c(H+).
点评 本题考查了酸碱混合时溶液定性判断及离子浓度大小比较,题目难度中等,注意掌握根据电荷守恒、物料守恒比较溶液中离子浓度定性关系的方法.注意把握混合溶液中溶质的分析.

 天天练口算系列答案
天天练口算系列答案 (1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).
(1)水的电离平衡曲线如图所示,若A点表示25℃时水的电离达平衡时的离子浓度,B点表示100℃时水的电离达平衡时的离子浓度.则100℃时1mol•L-1的NaOH溶液中,由水电离出的c(H+)=1×10-12mol•L-1.25℃时,向水的电离平衡体系中加入少量NH4Cl固体,对水的电离平衡的影响是促进(填“促进”、“抑制”或“不影响”).(2)电离平衡常数是衡量弱电解质电离程度强弱的量.已知如表数据.
| 化学式 | 电离平衡常数(25℃) |
| HCN | K=4.9×10-10 |
| CH3COOH | K=1.8×10-5 |
| H2CO3 | K1=4.3×10-7、K2=5.6×10-11 |
c(CH3COO-)(填“>”、“<”或“=”).
②25℃时,有等浓度的①NaCN溶液、②Na2CO3溶液、③CH3COONa溶液,三种溶液的pH由大到小的顺序为Na2CO3溶液>NaCN溶液>CH3COONa溶液.(填序号)
③向NaCN溶液中通入少量CO2,所发生反应的化学方程式为NaCN+H2O+CO2=HCN+NaHCO3.
| A. | 微粒半径大小:S2->Cl->Na+>Al3+>F- | |
| B. | 热稳定性大小:SiH4>PH3>NH3>H2O>HF | |
| C. | 密度大小:Rb>K>Na>Li | |
| D. | 等物质的量浓度溶液,酸性强弱顺序:HClO4>H2SO4>H3PO4>H2SiO3 |
| A. | CaF2 | B. | Na2O | C. | CuSO4•5H2O | D. | FeCl3 |
| A. | 正、逆反应速率都等于零 | B. | CO、H2S、COS、H2的浓度相等 | ||
| C. | CO、H2S、COS、H2在容器中共存 | D. | CO、H2S、COS、H2的浓度均不再变化 |
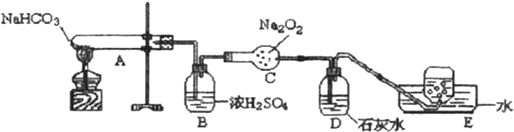
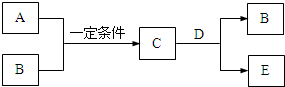 A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图:
A、B、C、D、E是中学化学中的常见物质,A、B是短周期元素组成的单质.其转化关系如图: