题目内容
5.在一定温度下,如图1,将等量的气体分别通入起始体积相同的密闭容器Ⅰ和Ⅱ中,使其发生反应,t0时容器Ⅰ中达到化学平衡,X、Y、Z的物质的量的变化如图2所示.则下列有关推断正确的是( )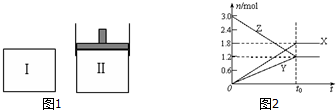
| A. | 该反应的化学方程式为:3X+2Y?2Z | |
| B. | 若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡所需时间小于t0 | |
| C. | 若两容器中均达到平衡时,两容器中Z的物质的量分数相同,则Y为固态或液态 | |
| D. | 若达平衡后,对容器Ⅱ升高温度时,其体积增大,说明Z发生的反应为吸热反应 |
分析 A、根据X、Y、Z物质的量的变化图象分析计算得到化学方程式;
B、根据计算得到的化学方程式的反应特点分析,Ⅰ是恒容容器,Ⅱ是恒压容器;
C、两容器中Z的物质的量分数相同说明达到相同的平衡状态;
D、升高温度平衡向吸热反应方向进行.
解答 解:A、根据X、Y、Z物质的量的变化图象分析,Z是反应物,XY是生成物,到平衡后,X生成1.8mol,Y生成1.2mol,Z反应1.8mol,则反应的化学方程式为:3Z?3X+2Y,故A错误;
B、反应的化学方程式为:3Z?3X+2Y,若两容器中均达到平衡时,两容器的体积V(Ⅰ)<V(Ⅱ),则容器Ⅱ达到平衡时体积增大、压强小,压强减小的过程,达到平衡所需时间大于t0,故B错误;
C、若两容器中均达到平衡时,两容器中Z的物质的量分数相同,说明达到相同的平衡,不受压强的变化影响,所以反应前后气体体积应是不变的反应,所以X为固态或液态,故C正确;
D、若达平衡后,容器Ⅱ是恒压容器,升高温度时其体积增大,但不能说明平衡正向进行,Z发生的反应不一定为吸热反应,故D错误;
故选C.
点评 本题考查了恒温容器和恒压容器的平衡影响条件的分析判断,主要考查影响化学平衡的因素,平衡移动的方向判断是关键.

练习册系列答案
相关题目
2.已知:SO32-+I2+H2O→SO42-+2I-+2H+.某溶液中可能含有Na+、NH4+、Fe2+、K+、I-、SO32-、SO42-,且所有离子物质的量浓度相等.向该无色溶液中滴加少量溴水,溶液仍呈无色.下列关于该溶液的判断正确的是( )
| A. | 肯定不含I- | B. | 肯定不含SO42- | C. | 肯定不含SO32- | D. | 肯定含有NH4+ |
3.下列说法不正确的是( )
| A. | 25℃时Kw=1.0×10-14,将稀硫酸加热至90℃(忽略溶液体积变化)其pH不变 | |
| B. | pH与体积都相同的醋酸和硝酸溶液分别用0.1mol•L-1氢氧化钠溶液恰好中和,所需的氢氧化钠溶液体积前者一定大于后者 | |
| C. | 0.2 mol•L-1CH3COONa溶液和0.1mol•L-1盐酸等体积混合所得碱性溶液中:c(Na+)+c(H+)=c(CH3COO-)+c(Cl-) | |
| D. | 向少量AgNO3溶液中滴加适量NaCl溶液,再滴加适量KI溶液,若开始有白色沉淀生成,后逐渐变为黄色沉淀,即说明Ksp(AgI)<Ksp(AgCl) |
20.在120℃,1.01×105Pa时,将3L炔烃和烷的混合气体与相同状态下的14LO2混合,充分燃烧烃/后恢复到原来状态时.所得气体的体积是17L.则下列各组烃的混合物中可能是( )
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
7.Mg、Ca、Sr、Ba是按原子序数由小到大的顺序排列的第ⅡA族元素.已知:①Mg(OH)2难溶于水,而Ca(OH)2微溶于水;②MgSO4溶于水,而CaSO4微溶于水.下列推测中,不正确的是( )
| A. | Sr(OH)2溶解于水 | B. | SrSO4难溶于水 | ||
| C. | BaSO4不溶于水 | D. | Ba(OH)2比Ca(OH)2更难溶于水 |
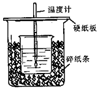 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: 为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).
为探究测定中和热的实验,小明利用50mL 0.50mol•L-1盐酸与50mL 0.55mol•L-1NaOH溶液,在如图所示的装置中进行中和反应,并通过测定反应过程中所放出的热量来计算中和热(中和热数值为57.3kJ/mol).