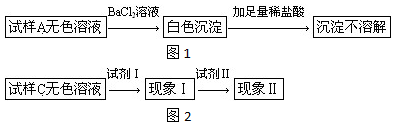
题目内容
2.已知2mol H2完全燃烧生成液态水放出572kJ热量.写出H2燃烧热的热化学反应方程式:H2(g)+$\frac{1}{2}$O2(g)=H2O(l)△H=-286kJ/mol.分析 2mol H2完全燃烧生成液态水放出572kJ热量,则1mol H2完全燃烧生成液态水放出热量为286kJ,燃烧热中可燃物为1mol,生成稳定氧化物,结合焓变为负来解答.
解答 解:2mol H2完全燃烧生成液态水放出572kJ热量,则1mol H2完全燃烧生成液态水放出热量为286kJ,则H2燃烧热的热化学反应方程式为H2(g)+$\frac{1}{2}$ O2(g)=H2O(l)△H=-286kJ/mol,
故答案为:H2(g)+$\frac{1}{2}$ O2(g)=H2O(l)△H=-286kJ/mol.
点评 本题考查热化学方程式的书写,为高频考点,把握燃烧热、物质的量与热量的关系为解答的关键,侧重分析与应用能力的考查,注意燃烧热中水为液态,题目难度不大.

练习册系列答案
相关题目
19.化学在日常生活和生产中有着重要的应用.下列说法不正确的是( )
| A. | 明矾水解形成的Al(OH)3胶体能吸附水中悬浮物,可用于水的净化 | |
| B. | 某雨水样品采集后放置一段时间,pH由4.68变为4.28,是因为溶液中的SO32- 发生水解 | |
| C. | 将饱和FeCl3溶液滴入沸水中可制备Fe(OH)3胶体,利用的是盐类水解原理 | |
| D. | 纯碱溶液呈碱性的原因是CO3 2-+H2O?HCO3-+OH- |
20.在120℃,1.01×105Pa时,将3L炔烃和烷的混合气体与相同状态下的14LO2混合,充分燃烧烃/后恢复到原来状态时.所得气体的体积是17L.则下列各组烃的混合物中可能是( )
| A. | C2H4和C2H6 | B. | C3H4和CH4 | C. | C2H2和CH4 | D. | C4H6和C2H6 |
7.下列有关物质的性质和应用均正确的是( )
| A. | Na2O2是碱性氧化物,具有强氧化性可用于杀菌消毒 | |
| B. | Fe在O2中的燃烧产物可用于制红色涂料 | |
| C. | 瓷坩埚能耐高温,可用于加热熔化烧碱、纯碱等固体 | |
| D. | Mg (OH)2分解吸热且生成高熔点固体,可用作阻燃剂 |
12.将一定量的镁和铜组成的混合物加入到稀硝酸中,金属恰好完全溶解(假设反应中还原产物只有NO).向反应后的溶液中加入3mol/L NaOH溶液至沉淀完全,测得生成沉淀的质量比原合金的质量增加 5.1g.下列叙述不正确的是( )
| A. | 当金属全部溶解时,参加反应的硝酸的物质的量一定是0.4 mol | |
| B. | 参加反应的金属的总质量 3.6 g<m<9.6 g | |
| C. | 当生成的沉淀量达到最大时,消耗NaOH溶液的体积V=200 mL | |
| D. | 当金属全部溶解时收集到NO气体的体积在标况下为 2.24 L |
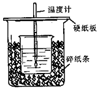 用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题:
用50mL0.50mol/L盐酸与50mL0.55mol/LNaOH溶液在如图所示的装置中进行中和反应.通过测定反应过程中所放出的热量可计算中和热.回答下列问题: