题目内容
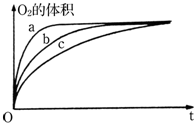
9.在a、b两支试管中,分别装入足量Na2CO3粉木,然后向两支试管中分别加入相同物质的段浓度、相同体积的稀盐酸和稀酷酸.填写下列空白.a、b 两支试管中生成气体的速率开始时是a大于b,反应完毕后生成气体的总体积是a等于b,原因是开始反应时盐酸中c(H+)大,但两者H+的总物质的量相等.
分析 盐酸是强酸,醋酸是弱酸,相同物质的量浓度、相同体积的稀盐酸和稀醋酸,盐酸中氢离子浓度大于醋酸,浓度越大反应速率越大;但相同物质的量浓度、相同体积的稀盐酸和稀醋酸提供氢离子的能力相同.
解答 解:盐酸是强酸,醋酸是弱酸,相同物质的量浓度、相同体积的稀盐酸和稀醋酸,盐酸中氢离子浓度大于醋酸,氢离子浓度越大反应速率越大,所以a、b 两支试管中生成气体的速率开始时是a大于b,但相同物质的量浓度、相同体积的稀盐酸和稀醋酸提供氢离子的能力相同,所以最终生成的二氧化碳气体的体积相同;
故答案为:大于;等于;开始反应时盐酸中c(H+)大,但两者H+的总物质的量相等.
点评 本题考查了弱电解质的电离、化学反应速率的因素,题目难度不大,注意强弱电解质的比较和影响反应速率的因素,注重基础知识的积累.

练习册系列答案
相关题目
19.下列烷烃中沸点最高的是( )
| A. | 乙烷 | B. | 正戊烷 | C. | 正丁烷 | D. | 新戊烷 |
20.下列化学用语表达正确的是( )
| A. | 一氯乙烷的结构式CH3Cl | B. | 乙醇分子的比例模型: | ||
| C. | N2的电子式: | D. | 苯的分子式C6H6 |
17.能正确表示下列化学反应的离子方程式是( )
| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | NaOH溶液中通入少量二氧化碳:CO2+OH-═HCO3- | |
| C. | 氧化铁与盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:OH-+H+═H2O |
4.下列有关物质“量”的说法正确的是( )
| A. | 相同物质的量的Al和A1(OH)3分别与等浓度的NaOH溶液反应,至体系中均无固体时,Al(OH)3消耗的碱量较多 | |
| B. | 反应N2O4+N2H4→N2+H2O中,若有1molN2O4参加反应,则有4mol电子发生转移 | |
| C. | 由Na2CO3和NaHCO3组成的混合物中,若n(Na+):n(C)=7:5,则n(Na2CO3):n(NaHCO3)=2:3 | |
| D. | 相同物质的量的浓硫酸分别与足量的铜和氧化铜反应,生成硫酸铜的两相同 |
18.下列离子方程式书写正确的是( )
| A. | 在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO${\;}_{3}^{-}$ | |
| B. | 用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ | |
| D. | 10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO${\;}_{4}^{2-}$═3BaSO4↓+2Al(OH)3↓ |
2.(1)填写表中空格:
(2)元素周期表中,第五周期共有元素18种,若第五周期第VA元素的序数为a,则第五周期第II A元素的序数为(用a代数式)a-13,第六周期第VA元素的序数为(用a代数式)a+32,
(3)紧临第VIII族之后的一个纵行为ⅠB族,周期表中所含元素种数最多的族是第ⅢB族,
(4)原子核外电子排布中,电子层的第四层又称(填字母)N层,某主族元素最外层有2个电子,第四层是它的次外层,此时该层应有电子18个.
(5)某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX分子,在ag HmX中所含质子的物质的量是$\frac{a}{m+A}$×(m+A-N)mol.
| 符号 | 质子数 | 电子数 |
| 1 | 0 | |
| NH4+ | ||
| Mn- | b |
(3)紧临第VIII族之后的一个纵行为ⅠB族,周期表中所含元素种数最多的族是第ⅢB族,
(4)原子核外电子排布中,电子层的第四层又称(填字母)N层,某主族元素最外层有2个电子,第四层是它的次外层,此时该层应有电子18个.
(5)某元素的一种同位素X的原子质量数为A,含N个中子,它与11H原子组成HmX分子,在ag HmX中所含质子的物质的量是$\frac{a}{m+A}$×(m+A-N)mol.
 将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程)
将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程)