题目内容
14.往200mL FeC13溶液中,通入0.672L标准状况下的H2S气体,气体完全被吸收,再加入过量的铁粉产生氢气,反应停止后,测得溶液中含有0.15mol金属阳离子,求:(1)FeC13溶液与H2S反应的离子方程式为2Fe3++H2S=2Fe2++S↓+2H+;
(2)加入过量铁粉充分反应后产生氢气在标准状况下的体积?
(3)原FeC13溶液的浓度为多少?
分析 氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,由此分析解答.
解答 解:(1)氯化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,故答案为:2Fe3++H2S=2 Fe2++S↓+2H+;
(2)通入0.672L标准状况下的H2S气体,气体完全被吸收,所以硫化氢中的氢全部转化为溶液中的氢离子,再加入过量的铁粉,则溶液中的氢离子全部转化为氢气,根据氢守恒,n(H2)=n(H2S),所以加入过量铁粉充分反应后产生氢气在标准状况下的体积为672mL,
答:加入过量铁粉充分反应后产生氢气在标准状况下的体积是672mL;
(3)化铁与硫化氢发生反应:2Fe3++H2S=2Fe2++S↓+2H+,与Fe发生反应:2Fe3++Fe=3Fe2+,由于Fe过量,生成的盐酸再和铁反应生成氯化亚铁,最终溶液为FeCl2溶液,最终溶液中0.15mol金属离子为Fe2+,
根据氯离子守恒:3n(FeCl3)=2n(FeCl2),即n(FeCl3)=$\frac{2}{3}$n(FeCl2)=0.15mol×$\frac{2}{3}$=0.1mol,
故原溶液中c(FeCl3)=$\frac{0.1mol}{0.2L}$=0.5mol/L,
答:原FeC13溶液的浓度为0.5 mo/L.
点评 本题考查混合物有关计算,明确发生的反应是解题关键,利用守恒法解答,避免方程式的繁琐,侧重考查学生分析计算能力,难度中等.

练习册系列答案
相关题目
4. 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4熔、沸点依次增高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强.
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂.Zn、Ge、O电负性由大至小的顺序是O>Ge>Zn.
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3微粒之间存在的作用力是共价键.
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为($\frac{1}{2}$,0,$\frac{1}{2}$);C为($\frac{1}{2}$,$\frac{1}{2}$,0).则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$).
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$g•cm-3(列出计算式即可).
 锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:
锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛.回答下列问题:(1)基态Ge原子的核外电子排布式为[Ar]3d104s24p2,有2个未成对电子.
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键.从原子结构角度分析,原因是锗的原子半径大,原子之间形成的ρ单键较长,p-p轨道肩并肩重叠程度很小或几乎不能重叠,难以形成π键.
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因GeCl4、GeBr4、GeI4熔、沸点依次增高;原因是分子结构相似,相对分子质量依次增大,分子间相互作用力逐渐增强.
| GeCl4 | GeBr4 | GeI4 | |
| 熔点/℃ | -49.5 | 26 | 146 |
| 沸点/℃ | 83.1 | 186 | 约400 |
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为sp3微粒之间存在的作用力是共价键.
(6)晶胞有两个基本要素:①原子坐标参数,表示晶胞内部各原子的相对位置,如图(1、2)为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为($\frac{1}{2}$,0,$\frac{1}{2}$);C为($\frac{1}{2}$,$\frac{1}{2}$,0).则D原子的坐标参数为($\frac{1}{4}$,$\frac{1}{4}$,$\frac{1}{4}$).
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76pm,其密度为$\frac{8×73}{6.02×{{565.76}^{3}}}×{{10}^{7}}$g•cm-3(列出计算式即可).
5.下列离子方程式正确的是( )
| A. | 铁与稀HNO3反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 向小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
2.油条是我国北方的传统食品,其做法是将明矾,碱,食盐按比例加入温水中,再加入面粉搅拌成面团,放置,使面团产生气体,形成孔洞,达到柔顺,放置过程发生反应:3Na2CO3+2KAl(SO4)2•12H2O═3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21H2O,下列有关判断正确的是( )
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
19.下列实验装置不能达到实验目的是( )
| A. |  用装置来制备氨气 | |
| B. |  用装置来验证Cu与浓硝酸反应的热量变化 | |
| C. |  用装置来验证氨气极易溶于水 | |
| D. |  用装置来除去Cl2中混有的HCl气体 |
3.下列反应中,被氧化与被还原的元素是同一元素的是( )
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
 ②
②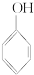 ③
③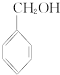 ④
④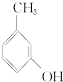 ⑤NaHSO 3溶液
⑤NaHSO 3溶液