题目内容
17.能正确表示下列化学反应的离子方程式是( )| A. | 氢氧化钡与硫酸反应:OH-+H+═H2O | |
| B. | NaOH溶液中通入少量二氧化碳:CO2+OH-═HCO3- | |
| C. | 氧化铁与盐酸混合:Fe2O3+6H+═2Fe3++3H2O | |
| D. | CH3COOH溶液与NaOH溶液反应:OH-+H+═H2O |
分析 A.漏掉了钡离子与硫酸根离子生成硫酸钡沉淀的反应;
B.二氧化碳少量,反应生成碳酸根离子;
C.氧化铁与盐酸反应生成氯化铁和水;
D.醋酸为弱酸,离子方程式中醋酸不能拆开.
解答 解:A.氢氧化钡与硫酸反应生成硫酸钡沉淀和水,正确的离子方程式为:2H++SO42-+Ba2++2OH-=BaSO4↓+2H2O,故A错误;
B.NaOH溶液中通入少量二氧化碳,反应生成碳酸钠,正确的离子方程式为:CO2+2OH-═CO32-+H2O,故B错误;
C.氧化铁与盐酸混合,反应生成氯化铁和水,反应的离子方程式为:Fe2O3+6H+═2Fe3++3H2O,故C正确;
D.醋酸为弱酸,需要保留分子式,正确的离子方程式为:CH3COOH+OH-═H2O+CH3COO-,故D错误;
故选C.
点评 本题考查了离子方程式的书写方法,题目难度中等,注意掌握离子方程式的书写原则,明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;试题侧重基础知识的考查,培养了学生的灵活应用能力.

练习册系列答案
 培优口算题卡系列答案
培优口算题卡系列答案 开心口算题卡系列答案
开心口算题卡系列答案 口算题卡河北少年儿童出版社系列答案
口算题卡河北少年儿童出版社系列答案
相关题目
7.城市居民所用的液化石油气成分为丁烷,在使用过程中常有一些杂质以液态形式沉积于钢瓶底部,这些杂质可能是( )
| A. | 丙烷 | B. | 乙烷和丙烷 | C. | 乙烷和甲烷 | D. | 戊烷和己烷 |
8.下列有机实验操作或叙述正确的是( )
| A. | 实验室配制银氨溶液时,应将2%硝酸银滴入2mL 2%的氨水中 | |
| B. | 除去乙酸乙酯中的部分乙醇和乙酸可用饱和Na2CO3溶液 | |
| C. | 卤代烃和酯的水解都可用浓硫酸作催化剂 | |
| D. | 在卤代烃水解后的溶液中加入硝酸银溶液观察沉淀现象就可确定其中的卤素 |
5.下列离子方程式正确的是( )
| A. | 铁与稀HNO3反应:Fe+2H+═Fe2++H2↑ | |
| B. | 大理石溶于醋酸中:CaCO3+2CH3COOH═Ca2++2CH3COO-+CO2↑+H2O | |
| C. | 氯化钙与碳酸氢钾溶液混合:Ca2++CO32-═CaCO3↓ | |
| D. | 向小苏打溶液中加入过量的澄清石灰水:2HCO3-+Ca2++2OH-═CaCO3↓+2H2O+CO32- |
2.油条是我国北方的传统食品,其做法是将明矾,碱,食盐按比例加入温水中,再加入面粉搅拌成面团,放置,使面团产生气体,形成孔洞,达到柔顺,放置过程发生反应:3Na2CO3+2KAl(SO4)2•12H2O═3Na2SO4+K2SO4+3CO2↑+2A1(OH)3↓+21H2O,下列有关判断正确的是( )
| A. | 从物质的分类角度来看,油条配方中的“明矾、碱”均属于盐 | |
| B. | 放置过程发生的反应为氧化还原反应 | |
| C. | 放置过程发生的反应中反应物和生成物均为电解质 | |
| D. | 反应的离子方程式为:3CO32-+2KAl(SO4)2•12H2O═3Na2SO4+2K++4SO42-+3CO2↑+2Al(OH)3↓+21 H2O |
7. 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
(1)过氧化氢分解的化学方程式为2H2O2$\frac{\underline{\;氯化铁\;}}{\;}$2H2O+O2↑.
(2)实验①的目的是探究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中)(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的即时速率.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是探究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中)(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的即时速率.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
 ②
②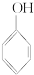 ③
③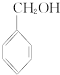 ④
④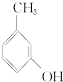 ⑤NaHSO 3溶液
⑤NaHSO 3溶液