题目内容
1. 将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程)
将9.6g铜单质置于200mL一定浓度的稀硝酸中,两者恰好完全反应.假定溶液体积不变,请回答下列问题:(要求写出计算过程) (1)反应生成的气体的体积(标况下);
(2)反应过程中转移电子的物质的量;
(3)参加反应的稀硝酸的物质的量浓度.
分析 硝酸具有强氧化性,铜和稀硝酸反应生成硝酸铜、一氧化氮和水,化学方程式为:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,根据反应方程式列出已知量与未知量的关系,由此分析解答.
解答 解:3Cu+8HNO3(稀)=3Cu(NO3)2+2NO↑+4H2O,转移电子的物质的量
192g 8mol 44.8L 6mol
9.6g n(HNO3) V(NO) n(e-)
$\frac{192}{9.6}=\frac{8}{n(HN{O}_{3})}=\frac{44.8}{V(NO)}=\frac{6}{n({e}^{-})}$
解之得:n(HNO3)=0.4mol;V(NO)=2.24L; n(e-)=0.3mol;
所以c(HNO3)=$\frac{0.4mol}{0.2L}$=2mol/L;
答:(1)反应生成的气体的体积(标况下)为2.24L;
(2)反应过程中转移电子的物质的量为:0.3mol;
(3)参加反应的稀硝酸的物质的量浓度为:2mol/L.
点评 本题考查硝酸的性质及根据性质进行计算,可以和不活泼金属如铜发生反应,既表现酸性又表现强氧化性,计算时注意相关物质的量的转化.

练习册系列答案
相关题目
16.下列指定反应的离子方程式正确的是( )
| A. | FeCl3溶液中Fe3+的水解:Fe3++3H2O═Fe(OH)3↓+3H+ | |
| B. | 用惰性电极电解MgCl2溶液:2Cl-+2H2O$\frac{\underline{\;电解\;}}{\;}$2OH-+H2↑+Cl2↑ | |
| C. | 邻羟基苯甲酸中加入足量NaHCO3溶液: +2HCO${\;}_{3}^{-}$→ +2HCO${\;}_{3}^{-}$→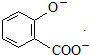 +2CO2↑+2H2O +2CO2↑+2H2O | |
| D. | 向含NaOH的Cu(OH)2悬浊液中加入乙醛溶液并加热:CH3CHO+2Cu(OH)2+OH-$\stackrel{△}{→}$CH3COO-+Cu2O↓+3H2O |
13.下列叙述正确的是( )
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C5H11Cl有8种同分异构体 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
10.下列有关氯元素及其化合物的表示正确的是( )
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: | |
| C. | 氯分子的电子式: | |
| D. | 氯化氢的结构式:H-Cl |
14.关于如图原电池装置的说法正确的是( )

| A. | Cu一定为正极 | |
| B. | 若溶液中的阴离子移向铁电极,则电流由铜电极经导线流向铁电极 | |
| C. | 若铜电极增重,则X可能为CuSO4、AgNO3、FeCl3等 | |
| D. | 若铜电极溶解,则铁电极表面可能有无色刺激性气味的气体产生 |
 ②
② ③
③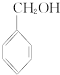 ④
④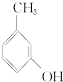 ⑤NaHSO 3溶液
⑤NaHSO 3溶液