题目内容
18.下列离子方程式书写正确的是( )| A. | 在NaClO溶液中通入过量SO2气体:ClO-+H2O+SO2═HClO+HSO${\;}_{3}^{-}$ | |
| B. | 用稀氢碘酸溶液除去铁制品表面的铁锈:Fe2O3+6H+═2Fe3++3H2O | |
| C. | NaHCO3与少量的Ca(OH)2溶液反应:Ca2++2OH-+2HCO${\;}_{3}^{-}$═CaCO3↓+2H2O+CO${\;}_{3}^{2-}$ | |
| D. | 10mL 0.5mol/L的明矾溶液与20mL 0.5mol/L Ba(OH)2溶液混合反应:3Ba2++6OH-+2Al3++3SO${\;}_{4}^{2-}$═3BaSO4↓+2Al(OH)3↓ |
分析 A.次氯酸具有强氧化性,能够将亚硫酸氢根离子氧化成硫酸根离子;
B.生成的铁离子具有氧化性,能够氧化碘离子;
C.氢氧化钙少量,离子方程式按照氢氧化钙的化学式组成书写;
D.根据n=cV分别计算出两溶液中钡离子、氢氧根离子、硫酸根离子、铝离子的物质的量,然后根据过量情况判断反应产物,最后写出反应的离子方程式.
解答 解:A.次氯酸钠具有强氧化性,能氧化二氧化硫生成硫酸根离子,自身被还原生成氯离子,正确的离子方程式为:ClO-+SO2+H2O=Cl-+SO42-+2H+,故A错误;
B.铁离子能够将碘离子氧化成碘单质,正确的离子方程式为:Fe2O3+6H++2I-=2Fe2++I2+3H2O,故B错误;
C.NaHCO3与少量的Ca(OH)2溶液,反应生成碳酸钙沉淀、碳酸钠和水,反应的离子方程式为:2HCO3-+2OH-+Ca2+=CaCO3↓+2H2O+CO32-,故C正确;
D.10mL 0.5mol/L的明矾溶液中含有0.005mol溶质,含有0.01mol硫酸根离子和0.005mol铝离子;20mL 0.5mol/L Ba(OH)2溶液中含有0.01mol氢氧化钡,含有0.01mol钡离子和0.02mol氢氧根离子,硫酸根与钡离子恰好反应生成硫酸钡沉淀,而氢氧根离子恰好与铝离子反应生成偏铝酸根离子,正确的离子方程式为:2Ba2++4OH-+Al3++2SO42-═2BaSO4↓+AlO2-+2H2O,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,题目难度中等,注意掌握离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合原化学方程式等;D为易错点,注意正确判断反应物过量情况及反应产物.

| A. | 实验室配制银氨溶液时,应将2%硝酸银滴入2mL 2%的氨水中 | |
| B. | 除去乙酸乙酯中的部分乙醇和乙酸可用饱和Na2CO3溶液 | |
| C. | 卤代烃和酯的水解都可用浓硫酸作催化剂 | |
| D. | 在卤代烃水解后的溶液中加入硝酸银溶液观察沉淀现象就可确定其中的卤素 |
| A. | 聚氯乙烯与乙烯性质相似,可使溴水褪色 | |
| B. | 甲烷和Cl2的反应与乙烯和Br2的反应属于同一类型的反应 | |
| C. | C5H11Cl有8种同分异构体 | |
| D. | 相同条件下,熔沸点:正丁烷<异丁烷 |
| A. | Cl2+2NaOH═NaCl+NaClO+H2O | B. | Fe+CuSO4═FeSO4+Cu | ||
| C. | 2KClO3$\frac{\underline{MnO_2}}{△}$2KCl+3O2↑ | D. | 3NO2+H2O=2HNO3+NO |
| A. | 质子数为17、中子数为20的氯原子:${\;}_{17}^{20}$Cl | |
| B. | 氯离子(Cl-)的结构示意图: | |
| C. | 氯分子的电子式: | |
| D. | 氯化氢的结构式:H-Cl |
 为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.
为了研究外界条件对过氧化氢分解速率的影响,某同学做了以下实验,请回答下列问题.| 编号 | 操作 | 实验现象 |
| ① | 分别在试管A、B中加入5mL 5% H2O2溶液,各滴入2滴1mol/L FeCl3溶液.待试管中均有适量气泡出现时,将试管A放入盛有5℃左右冷水的烧杯中浸泡;将试管B放入盛有40℃左右热水的烧杯中浸泡. | 试管A中不再产生气泡; 试管B中产生的气泡量增大. |
| ② | 另取两支试管分别加入5mL 5% H2O2溶液和5mL 10% H2O2溶液 | 试管A、B中均未明显见到有气泡产生. |
(2)实验①的目的是探究温度对H2O2分解速率的影响.
实验中滴加FeCl3溶液的目的是加快H2O2分解速率,使实验现象易于观察.
(3)实验②未观察到预期的实验现象,为了帮助该同学达到实验目的,你提出的对上述操作的改进意见是分别在两支试管中加入等量的FeCl3溶液(或将两支试管同时放入盛有相同温度热水的烧杯中)(用实验中所提供的几种试剂).
(4)某同学在50mL一定浓度的H2O2溶液中加入一定量的二氧化锰,放出气体的体积(标准状况下)与反应时间的关系如图所示,则A、B、C三点所表示的瞬时反应速率最慢的是C点的即时速率.
(5)对于H2O2分解反应,Cu2+也有一定的催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,某化学研究小组的同学分别设计了如图甲、乙所示的实验.请回答相关问题:

①定性分析:如图甲可通过观察,定性比较得出结论.有同学提出将FeCl3改为Fe2(SO4)3更为合理,其理由是硫酸铁和硫酸铜阴离子相同,可以消除阴离子不同对实验的干扰.
②定量分析:用图乙所示装置做对照实验,实验时均以生成40mL气体为准,其他可能影响实验的因素均已忽略.实验中需要测量的数据是产生40ml气体所需要的时间.
 ②
②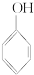 ③
③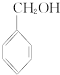 ④
④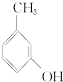 ⑤NaHSO 3溶液
⑤NaHSO 3溶液