题目内容
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL NO2气体和224mL的NO气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、7.04 g |
| B、8.26 g |
| C、8.51 g |
| D、9.02 g |
考点:有关混合物反应的计算
专题:
分析:最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,根据电子转移守恒计算金属失去电子物质的量,沉淀质量等于金属质量与氢氧根离子质量之和.
解答:
解:4.48L的 NO2气体的物质的量为
=0.2mol,0.224L的NO气体物质的量为
=0.01mol,根据电子转移守恒,金属失去电子物质的量0.2mol×1+0.01mol×3=0.23mol,
最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.6g+0.23mol×17g/mol=8.51g,
故选C.
| 4.48L |
| 22.4L/mol |
| 0.224L |
| 22.4L/mol |
最终生成沉淀为Cu(OH)2和Mg(OH)2,根据电荷守恒可知,金属失去电子物质的量等于沉淀中氢氧根的物质的量,故沉淀质量为4.6g+0.23mol×17g/mol=8.51g,
故选C.
点评:本题考查混合物计算,侧重解题方法与分析思维能力的考查,注意利用守恒法解答,难度中等.

练习册系列答案
 小学教材全测系列答案
小学教材全测系列答案 小学数学口算题卡脱口而出系列答案
小学数学口算题卡脱口而出系列答案 优秀生应用题卡口算天天练系列答案
优秀生应用题卡口算天天练系列答案
相关题目
下列装置或操作能达到目的是( )
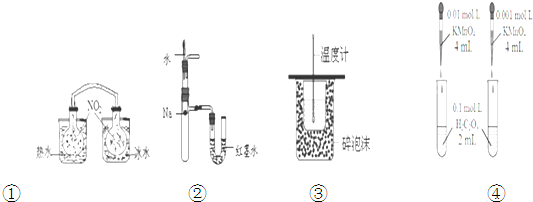

| A、装置①依据两容器内气体颜色变化,不能判断反应2NO2(g)?N2O4(g)平衡移动的方向 |
| B、装置②依据U管两边液面的高低判断Na和水反应的热效应 |
| C、装置③测定中和热 |
| D、装置④依据褪色快慢比较浓度对反应速率的影响 |
对于某些离子的检验及结论一定正确的是( )
| A、取样,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、取样,加入硝酸银有白色沉淀,一定有Cl- |
| C、取样,加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、取样,滴加KSCN溶液,不显红色,再滴加氯水后显红色,一定有Fe2+ |
类比乙烯和乙醇的化学性质,推测丙烯醇(CH2═CHCH2OH)可发生的化学反应( )
①与金属钠反应产生氢气;
②可与氧气发生催化氧化反应
③能与溴水发生加成反应而使其褪色;
④与Na2CO3溶液反应放出CO2.
①与金属钠反应产生氢气;
②可与氧气发生催化氧化反应
③能与溴水发生加成反应而使其褪色;
④与Na2CO3溶液反应放出CO2.
| A、①② | B、①③④ |
| C、②③④ | D、①②③ |
在AgCl饱和溶液中尚有AgCl固体存在,当向溶液中加入0.1mol/L的盐酸时,下列说法正确的是( )
| A、AgCl沉淀溶解平衡正向移动 |
| B、AgCl溶解度增大 |
| C、溶液中c(Ag+)增大 |
| D、溶液中c(Cl-)增大 |
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.


