题目内容
 能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.
能源问题日益成为制约国际社会经济发展的瓶颈,越来越多的国家开始实行“阳光计划”,开发太阳能资源,寻求经济发展的新动力.(1)太阳能热水器中常使用一种以镍(原子序数比铁大2)或镍合金空心球为吸收剂的太阳能吸热涂层,写出基态镍原子的价层电子排布式
(2)与镍同族的钴(Co)可形成分子式均为Co(NH3)5BrSO4的两种配合物,其中一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液时,将产生
(3)多元化合物薄膜太阳能电池材料为无机盐,其主要包括砷化镓、硫化镉、硫化锌及铜锢硒薄膜电池等.
①第一电离能:As
(4)金属酞菁配合物在硅太阳能电池中有重要作用,一种金属镁酞菁配合物的结构如图,请在图中用箭头表示出配位键.该配合物的配位原子是
考点:原子核外电子排布,元素电离能、电负性的含义及应用,配合物的成键情况
专题:化学键与晶体结构
分析:(1)28号元素镍,核外有28个电子,根据构造原理写出其基态镍原子的核外电子排布式的简化形式;
(2)根据配合物的组成进行分析;
(3)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,注意第VA族元素大于相邻元素的第一电离能;
根据价层电子对互斥理论确定其空间构型;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子.
(2)根据配合物的组成进行分析;
(3)同一周期元素的第一电离能随着原子序数的增大而呈增大的趋势,注意第VA族元素大于相邻元素的第一电离能;
根据价层电子对互斥理论确定其空间构型;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子.
解答:
解:(1)28号元素镍,核外有28个电子,根据构造原理知其基态镍原子的核外电子排布式的简化形式为:[Ar]3d84s2,故答案为:[Ar]3d84s2;
(2)一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液,发生反应SO42-+Ba2+=BaSO4往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co(NH3)5SO4]Br;故答案为:白色沉淀;[Co(NH3)5SO4]Br;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,二氧化硒分子中价层电子对=2+
(6-2×2)=3,且含有一个孤电子对,所以属于V形,故答案为:>;V形;
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为 ,该配位原子为N原子,中心原子Mg周围与4个氮原子相连,其配位数为4,故答案为:
,该配位原子为N原子,中心原子Mg周围与4个氮原子相连,其配位数为4,故答案为: ;N;4.
;N;4.
(2)一种化学式为[Co(NH3)5Br]SO4,往其溶液中加BaCl2溶液,发生反应SO42-+Ba2+=BaSO4往另一种配合物的溶液中加入BaCl2溶液时,无明显现象,若加入AgNO3溶液时,产生淡黄色沉淀,该配合物能电离出Br-,则其化学式为:[Co(NH3)5SO4]Br;故答案为:白色沉淀;[Co(NH3)5SO4]Br;
(3)As和Se属于同一周期,且As属于第VA族,Se属于第VIA族,所以第一电离能As>Se,二氧化硒分子中价层电子对=2+
| 1 |
| 2 |
(4)配位键由提供孤电子对的原子指向提供空轨道的原子,所以该配合物中的配位键为
 ,该配位原子为N原子,中心原子Mg周围与4个氮原子相连,其配位数为4,故答案为:
,该配位原子为N原子,中心原子Mg周围与4个氮原子相连,其配位数为4,故答案为: ;N;4.
;N;4.
点评:本题考查了核外电子排布式的书写、配位键、分子构型等知识点,也是高考热点,注意配位键中箭头方向,为易错点.

练习册系列答案
 应用题点拨系列答案
应用题点拨系列答案 状元及第系列答案
状元及第系列答案 同步奥数系列答案
同步奥数系列答案
相关题目
下列有关实验操作说法中,正确的是( )
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体.
①用pH试纸测得氯水的pH为2
②用量筒、试管胶头滴管、玻璃棒、蒸馏水和pH试纸,可鉴别pH相等的硫酸和醋酸
③在进行分液操作时,分液漏斗中下层液体从下口放出,上层液体从上口倒出
④用碱式滴定管量取25.00mL溴水
⑤可用渗析的方法除去淀粉中混有的少量NaCl杂质
⑥在进行过滤操作时,为了加快速率,可用玻璃棒不断搅拌过滤器中液体.
| A、①③⑤ | B、②③⑤ |
| C、③④⑤ | D、①③④⑥ |
进行化学实验必须注意安全,下列说法不正确的是( )
| A、不慎将酸溅到眼中,应立即用大量水冲洗,边洗边眨眼睛 |
| B、不慎将浓碱溶液沾到皮肤上,应立即用大量的水冲洗 |
| C、加热试管或烧杯时,应首先擦干外壁上的水 |
| D、配制硫酸溶液时,可先在量筒中加入一定体积的水,再在搅拌条件下慢慢加入浓硫酸 |
下列实验基本操作中不正确的是( )
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL NO2气体和224mL的NO气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、7.04 g |
| B、8.26 g |
| C、8.51 g |
| D、9.02 g |
下列物质与常用危险化学品的类别不对应的是( )
| A、浓硫酸--腐蚀品 |
| B、烧碱--剧毒品 |
| C、汽油--易燃液体 |
| D、天然气--易燃气体 |
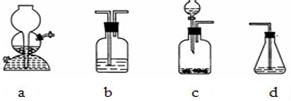 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.