题目内容
NH3经一系列反应可以得到HNO3,如图1所示.
(1)Ⅰ中,NH3 和O2在催化剂作用下反应,其化学方程式是 .
(2)Ⅱ中,2NO(g)+O2═2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2).
①比较P1、P2的大小关系: .
②随温度升高,该反应平衡常数变化的趋势是 .
③△H 0
(3)Ⅰ中生成NO 在汽车尾气中可以产生.①已知气缸中生成NO的反应为:
N2(g)+O2(g)?2NO(g)△H>0;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是 .
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据 .
(4)Ⅲ中,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)═N2O4(g)△H;当温度升高时,气体颜色变深,则反应为 (填“吸热”或“放热”)反应.
②一定温度下,反应(Ⅱ)的焓变为△H.现将1molN2O4充入一恒容密闭容器中,下列图3示意图正确且能说明反应达到平衡状态的是 .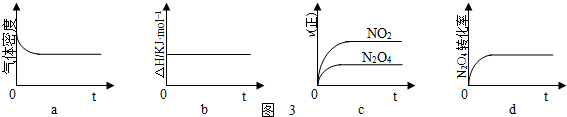
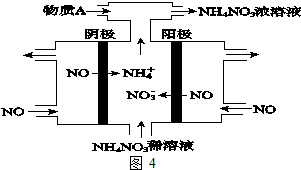
(5)Ⅳ中,电解NO制备 NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是 ,阴极的电极反应 .

(1)Ⅰ中,NH3 和O2在催化剂作用下反应,其化学方程式是
(2)Ⅱ中,2NO(g)+O2═2NO2(g).在其他条件相同时,分别测得NO的平衡转化率在不同压强(P1、P2)下温度变化的曲线(如图2).
①比较P1、P2的大小关系:
②随温度升高,该反应平衡常数变化的趋势是
③△H
(3)Ⅰ中生成NO 在汽车尾气中可以产生.①已知气缸中生成NO的反应为:
N2(g)+O2(g)?2NO(g)△H>0;汽车启动后,气缸温度越高,单位时间内NO排放量越大,原因是
②汽车燃油不完全燃烧时产生CO,有人设想按下列反应除去CO:
2CO(g)=2C(s)+O2(g)已知该反应的△H>0,简述该设想能否实现的依据
(4)Ⅲ中,将NO2(g)转化为N2O4(l),再制备浓硝酸.
①已知:2NO2(g)═N2O4(g)△H;当温度升高时,气体颜色变深,则反应为
②一定温度下,反应(Ⅱ)的焓变为△H.现将1molN2O4充入一恒容密闭容器中,下列图3示意图正确且能说明反应达到平衡状态的是

(5)Ⅳ中,电解NO制备 NH4NO3,其工作原理如图4所示,为使电解产物全部转化为NH4NO3,需补充物质A,A是

考点:化学平衡的计算,化学平衡的影响因素,化学平衡状态的判断,电解原理,氨的化学性质
专题:
分析:(1)氨气与氧气在催化剂加热的条件下生成NO与水;
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,根据压强对平衡的影响分析;
②根据图象2判断该反应正方向是放热还是吸热,再判断K随温度的变化;
③根据图象2判断该反应正方向是放热还是吸热;
(3)①依据化学平衡时气体体积不变的吸热反应,依据影响化学平衡的因素分析;
②根据G=△H-T?△S判断反应能否自发进行;
(4)①升高温度,平衡向吸热反应方向移动;
②根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(5)根据电解NO制备NH4NO3的反应方程式分析判断;
电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O.
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,根据压强对平衡的影响分析;
②根据图象2判断该反应正方向是放热还是吸热,再判断K随温度的变化;
③根据图象2判断该反应正方向是放热还是吸热;
(3)①依据化学平衡时气体体积不变的吸热反应,依据影响化学平衡的因素分析;
②根据G=△H-T?△S判断反应能否自发进行;
(4)①升高温度,平衡向吸热反应方向移动;
②根据达到平衡状态,各组分浓度不变,正逆反应速率相等进行判断;
(5)根据电解NO制备NH4NO3的反应方程式分析判断;
电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O.
解答:
解:(1)氨气与氧气在催化剂加热的条件下生成NO与水,反应方程式为:4NH3+5O2
4NO+6H2O,故答案为:4NH3+5O2
4NO+6H2O;
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知P2时NO的转化率大,则P2时压强大,即P1<P2,故答案为:P1<P2;
②由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K变小,故答案为:变小;
③由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,△H<0,故答案为:<;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,NO产量增加,故答案为:升高温度,平衡正移NO产量增加;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T?△S,△H>0,△S<0,△H-T△S>0,G>0,不能实现,
故答案为:△H>0,△S<0,△H-T△S>0,G>0,该反应在任何条件下都不能发生;
(4)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是放热反应,故答案为:放热;
②a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad;
(5)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
3NH4NO3+2HNO3,因此若要使电解产物全部转化为NH4NO3,需补充NH3,
故答案为:NH3;NO+5e-+6H+=NH4++H2O.
| ||
| △ |
| ||
| △ |
(2)①已知2NO(g)+O2(g)?2N02(g)是正方向体积减小的反应,增大压强平衡正移,则NO的转化率会增大,由图可知P2时NO的转化率大,则P2时压强大,即P1<P2,故答案为:P1<P2;
②由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,所以升高温度平衡常数K变小,故答案为:变小;
③由图象2可知,随着温度的升高,NO的转化率减小,说明升高温度平衡逆移,则该反应正方向是放热反应,△H<0,故答案为:<;
(3)①气缸温度越高,单位时间内NO排放量越大,原因是温度升高,反应速率加快,平衡右移,NO产量增加,故答案为:升高温度,平衡正移NO产量增加;
②2CO(g)=2C(s)+O2(g),该反应是焓增、熵减的反应.根据G=△H-T?△S,△H>0,△S<0,△H-T△S>0,G>0,不能实现,
故答案为:△H>0,△S<0,△H-T△S>0,G>0,该反应在任何条件下都不能发生;
(4)①升高温度,化学平衡向吸热反应方向移动,当温度升高时,气体颜色变深,平衡向正反应方向移动,所以正反应是放热反应,故答案为:放热;
②a、反应方程式两边气体的质量不相等,密度不变,说明达到了平衡状态,故a正确;
b、反应过程中,反应热不会变化,不是变量,无法判断是否达到平衡状态,故b错误;
c、根据反应速率大小,无法判断正逆反应速率是否相等,故c错误;
d、四氧化二氮的转化率不变,说明正逆反应速率相等,达到了平衡状态,故d正确;
故答案为:ad;
(5)电解NO制备NH4NO3,阳极反应为NO-3e-+2H2O=NO3-+4H+,阴极反应为:NO+5e-+6H+=NH4++H2O,从两极反应可看出,要使得失电子守恒,阳极产生的NO3-的物质的量大于阴极产生的NH4+的物质的量,总反应方程式为:8NO+7H2O
| ||
故答案为:NH3;NO+5e-+6H+=NH4++H2O.
点评:本题以氨气为载体考查了氧化还原反应、电解原理、化学平衡等知识点,综合性较强,采用“定一议二”的方法分析(2)题,正确书写电极反应式是解(5)题关键,难度中等.

练习册系列答案
相关题目
下列实验基本操作中不正确的是( )
| A、用量筒量取液体时,视线与量筒内液体凹液面最低处保持水平 |
| B、稀释浓硫酸时,把浓硫酸慢慢倒入盛有水的烧杯中并搅拌 |
| C、用胶头滴管向试管中加入液体时,胶头滴管紧贴试管内壁 |
| D、用托盘天平称量物质时,称量物放在左盘,砝码放在右盘 |
铜和镁的合金4.6g完全溶于浓硝酸,若反应中硝酸被还原只产生4480mL NO2气体和224mL的NO气体(气体的体积已折算到标准状况),在反应后的溶液中,加入足量的氢氧化钠溶液,生成沉淀的质量为( )
| A、7.04 g |
| B、8.26 g |
| C、8.51 g |
| D、9.02 g |
100ml 6mol/L H2SO4与过量锌粉反应,一定温度下,为了减缓反应进行的速率,但又不影响生成氢气的总量,可向反应物中加入适量的( )
| A、Na2SO4(s) |
| B、H2O |
| C、K2SO4溶液 |
| D、4mol/L H2SO4? |
 已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )
已知可逆反应:mA(g)+nB(1)?pC(g).改变温度(其他条件不变)、压强(其他条件不变)对上述反应正逆反应速率的影响分别如图所示,以下叙述正确的是( )| A、m>p,正反应为放热反应 |
| B、m<p,正反应为吸热反应 |
| C、m+n<p,正反应为放热反应 |
| D、m+n<p,正反应为吸热反应 |
下列物质与常用危险化学品的类别不对应的是( )
| A、浓硫酸--腐蚀品 |
| B、烧碱--剧毒品 |
| C、汽油--易燃液体 |
| D、天然气--易燃气体 |
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
| A、正丁烷 | B、异丁烷 |
| C、异戊烷 | D、新戊烷 |
 为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
为探究乙炔与溴的加成反应,甲同学设计并进行了如下实验:先取一定量工业用电石与水反应,将生成的气体通入溴水中,发现溶液褪色,即证明乙炔与溴水发生了加成反应.
 的名称是
的名称是 的分子式是
的分子式是