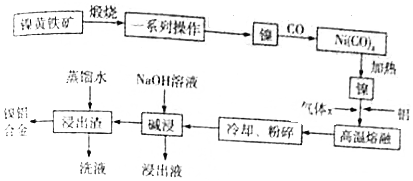
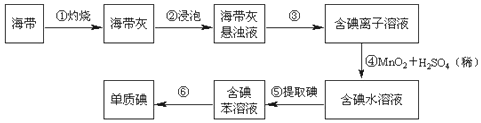
题目内容
10.资料显示不同浓度的硫酸与锌反应,硫酸可以被还原为SO2,也可能被还原为H2,为了验证这一事实.某同学拟用如图装置进行试验(实验中气体体积均按标况处理).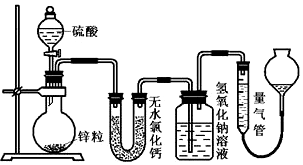
(1)若在烧瓶中放入1.30g锌粒,与c mol/L H2SO4反应,为保证实验结论的可靠,在洗气瓶中加入1mol/LNaOH溶液的体积≥20mL,量气管的适宜规格是500mL(选填:200mL,400mL,500mL ).
(2)若1.30g锌粒完全溶解,氢氧化钠洗气瓶增重l.28g,则烧瓶中发生反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O
(3)若烧瓶中投入ag锌且完全反应,氢氧化钠洗气瓶增重b g.量气瓶中收集到VmL(标况)气体,则依据电子得失守恒:a、b、V 三者建立的等式关系可表示为:$\frac{a}{65}$=$\frac{b}{64}$+$\frac{V}{22400}$.
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,则整个实验过程产生的气体中,$\frac{n({H}_{2})}{n(S{O}_{2})}$=$\frac{64CV-2m}{m}$ (用含字母的代数式表示,不必化简).
分析 (1)氢氧化钠吸收二氧化硫,为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液除去二氧化硫,根据锌的质量计算生成气体的体积,从而确定量气管的适宜规格;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,据此写出相应的化学反应方程式;
(3)根据氧化还原反应的特点分析,氧化还原反应中氧化剂得到的电子等于还原剂失去的电子,据此守恒列式计算;
(4)根据氢氧化钠洗气瓶增重的量求出反应的硫酸的物质的量,硫酸总量减去生成二氧化硫需要的硫酸的量即为生成氢气的硫酸的量,继而求出生成气体的物质的量.
解答 解:(1)为保证实验结论的可靠,在洗气瓶中加入1mol/L NaOH溶液除去二氧化硫,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
1 1
$\frac{1.30g}{65g/mol}$ 0.02mol
SO2 +NaOH=NaHSO3;
0.02mol 0.02mol
需要1mol/L NaOH溶液的体积最少为$\frac{0.02mol}{1mol/L}$=0.02L,即V≥20ml;
Zn+H2SO4=ZnSO4+H2↑
1mol 22.4L
$\frac{1.30g}{65g/mol}$ 0.448L
0.448L=448mL,故选500ml的量筒,
故答案为:20;500;
(2)氢氧化钠是碱,能吸收酸性气体,氢氧化钠洗气瓶增重说明有酸性气体生成,当锌和硫酸反应时,锌作还原剂,硫酸作氧化剂,被还原为二氧化硫,由(1)计算可知,1.30g锌和硫酸反应若只生成二氧化硫,共生成0.02mol,质量为0.02mol×64g/mol=1.28g,和氢氧化钠增重吻合,故发生反应的化学方程式为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O,
故答案为:Zn+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$ZnSO4+SO2↑+2H2O;
(3)根据氧化还原反应中得失电子数相等列出式子.若烧瓶中投入a g锌且完全反应,氢氧化钠洗气瓶增重b g,量气瓶中收集到Vml气体,
则依据化学反应方程式:Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O、Zn+H2SO4=ZnSO4+H2↑,
由电子守恒列式计算有:ag/65g•mol-1×2=bg/64g•mol-1×2+V ml/22400ml•mol-1×2得到$\frac{a}{65}$=$\frac{b}{64}$+$\frac{V}{22400}$,
故答案为:$\frac{a}{65}$=$\frac{b}{64}$+$\frac{V}{22400}$;
(4)若在烧瓶中投入d g锌,加入一定量的c mol/L 浓硫酸V L,充分反应后锌有剩余,测得氢氧化钠洗气瓶增重mg,
Zn+2H2SO4(浓)=ZnSO4+SO2↑+2H2O
2mol 1mol
$\frac{m}{32}$mol $\frac{m}{64}$mol
生成二氧化硫需要的硫酸为$\frac{m}{32}$mol;
Zn+H2SO4=ZnSO4+H2↑
1mol 1mol
(CV-$\frac{m}{32}$)mol (CV-$\frac{m}{32}$)mol
$\frac{n({H}_{2})}{n(S{O}_{2})}$=$\frac{CV-\frac{m}{32}}{\frac{m}{64}}$=$\frac{64CV-2m}{m}$,
故答案为:$\frac{64CV-2m}{m}$.
点评 本题考查了排气量气装置,要注意的是锌和硫酸的反应,硫酸浓度不同时,锌和硫酸反应的生成物不同,表现氧化性的元素也不同,题目难度中等,计算较多,注意注意把握实验原理和守恒原理的应用.

 尖子生新课堂课时作业系列答案
尖子生新课堂课时作业系列答案 英才计划同步课时高效训练系列答案
英才计划同步课时高效训练系列答案| A. | 46g乙醇中存在的共价键总数为7NA | |
| B. | 1L 0.1mol•L-1的NaHCO3-溶液中HCO3-离子数为0.1NA | |
| C. | 钠在空气中燃烧可生成多种氧化物,23g钠充分燃烧时转移电子数为1NA | |
| D. | 235g核互${\;}_{92}^{235}$U发生裂变反应:${\;}_{92}^{235}$U+${\;}_{0}^{1}$n$\stackrel{裂变}{→}$${\;}_{38}^{90}$Sr+${\;}_{54}^{136}$U+10${\;}_{0}^{1}$n净产生的中子(${\;}_{0}^{1}$n)数为1 |
| A. | 加大CaCO3的量 | B. | 加大盐酸的浓度 | C. | 加大盐酸的量 | D. | 减少CaCl2的浓度 |

已知:
| 物质 | 熔点/℃ | 沸点/℃ | 密度/g•cm-3 | 溶解性 |
| S | 113 | 444 | 1.96 | 不溶于水 |
| S2Cl2 | -76 | 138 | 1.75 | 与水反应 |
| CS2 | -109 | 47 | 1.26 | 不溶于水 |
| CCl4 | -23 | 77 | 1.59 | 不溶于水 |
①通入C12 ②熄灭装置A中酒精灯 ③通入冷水④关闭冷水 ⑤加热装置D ⑥熄灭装置D中酒精灯
(2)为获得平缓稳定的Cl2气流,A装置的操作是控制分液漏斗下端的活塞,使浓盐酸匀速滴下.
(3)装置C中盛有的试剂是无水CaCl2(或P2O5);装置B中盛的试剂是饱和食盐水.
(4)装置D中冷凝管的作用是导气、冷凝回流;装置E的作用是防倒吸
(5)实验过程中,若缺少C装置,则产品浑浊不清并产生2种酸性气体,写出其反应的化学方程式2S2Cl2+2H2O═3S↓+SO2↑+4HCl↑.
| A. | 等浓度的下列溶液①(NH4)2CO3、②(NH4)2SO4、③(NH4)2FeSO4 ④NH3•H2O,NH4+浓度大小顺序: ④>③>②>① | |
| B. | PH值相同的①NH4Cl ②(NH4)2SO4 ③NH4HSO4三种溶液中,NH4+浓度大小顺序:③>②>① | |
| C. | 等浓度的①CH3COONH4 ②NH4HCO3 ③(NH4)2CO3PH大小关系:③>②>① | |
| D. | 等浓度等体积NH4Cl与NH3.H2O混合液的物量守恒:c(NH4+)+c(NH3.H2O)=c(Cl-) |