题目内容
1.比较下列各组热化学方程式中△H的大小关系:(1)CH4(g)+2O2(g)═CO2(g)+2H2O(l)△H1
CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
△H1<△H2;(填><或“=”,下同);
(2)S(s)+O2(g)═SO2(g)△H1
S(g)+O2(g)═SO2(g)△H2
△H1>△H2.
分析 (1)水由气态变成液态,放出热量;
(2)固体硫燃烧时要先变为气态硫,过程吸热.
解答 解:(1)反应物都一样,水由气态变成液态,放出热量,所以生成液态水放出的热量多,但反应热为负值,所以△H1<△H2;
故答案为:<;
(2)固体硫燃烧时要先变为气态硫,过程吸热,所以气态硫具有的能量高,即气态硫放出的热量多,但反应热为负值,所以△H1>△H2;
故答案为:>.
点评 本题考查反应中热量大小比较,题目难度不大,注意把握物质的聚集状态不同,反应放出或吸收的热量是不同的.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
11.常温下将pH=3的盐酸与pH=11的氨水等体积混合后,离子浓度大小关系正确的是( )
| A. | c(NH4+)>c(Cl-)>c(H+)>c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(NH4+)+c(H+)>c(Cl-)+c(OH-) |
13.为了检验某FeCl2溶液是否变质,应选用的试剂是( )
| A. | 稀盐酸 | B. | KSCN溶液 | C. | 铁粉 | D. | 石蕊试液 |
10.下列方程式书写正确的是( )
| A. | H2CO3的电离方程式H2CO3?2H++CO32- | |
| B. | HCO3-在水溶液中的电离方程式:HCO3-+H2O?H3O++CO32- | |
| C. | NaOH的电离方程式:NaOH?Na++OH- | |
| D. | CaCO3的电离方程式:CaCO3?Ca2++CO32- |
11.下列关于物质的分类中正确的是( )
| 纯净物 | 混合物 | 强电解质 | 弱电解质 | 非电解质 | |
| A | 盐酸 | 漂白粉 | 硫酸 | 醋酸 | 干冰 |
| B | 氢氧化钡 | 蔗糖溶液 | 氯化银 | 溴水 | 二氧化硫 |
| C | 胆矾 | 石灰水 | 氧化铝 | 水 | 氯气 |
| D | 小苏打 | 氢氧化 铁胶体 | 胆矾 | 次氯酸 | 酒精 |
| A. | A | B. | B | C. | C | D. | D |
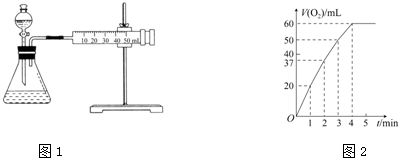
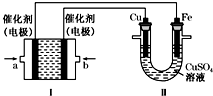 回答下列问题:
回答下列问题: