题目内容
12.氧化剂H2O2在反应时不产生污染物,被称为绿色氧化剂,因而受到人们越来越多的关注.资料显示,某些金属离子对H2O2的分解起催化作用.为比较Fe3+和Cu2+对H2O2分解的催化效果,该实验小组的同学设计了如图1所示的实验装置进行实验.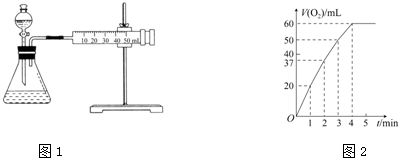
(1)某同学通过测定O2体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)0.1g MnO2粉末加入50mL H2O2溶液中,在标准状况下放出气体的体积和时间的关系如图2所示.解释反应速率变化的原因随着反应的进行,浓度减小,反应速率减慢,计算H2O2的初始物质的量浓度为0.11 mol/L(保留两位有效数字,在标准状况下测定)
分析 (1)实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较;
(2)随着反应的进行,溶液的浓度逐渐降低,反应速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,根据2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑进行计算.
解答 解:(1)通过测定O2的体积来比较H2O2的分解速率快慢,实验时可以通过测量单位时间生成O2的体积或生成单位体积O2所需要的时间来比较,
故答案为:单位时间生成O2的体积;生成单位体积O2所需要的时间;
(2)浓度越大,反应速率越大,反之越小,随着反应进行,反应物的浓度逐渐减小,则速率逐渐减小;根据图象可以看出H2O2完全反应放出60 mL O2,H2O2的分解反应为2H2O2$\frac{\underline{\;催化剂\;}}{\;}$2H2O+O2↑,则:n(H2O2)=$\frac{0.06L}{22.4L/mol}$×2≈0.00536 mol,
所以H2O2的初始物质的量浓度为:c(H2O2)=$\frac{0.00536mol}{0.05L}$≈0.11 mol/L,
故答案为:随着反应的进行,浓度减小,反应速率减慢;0.11 mol/L.
点评 本题考查了化学反应速率的影响因素,题目难度中等,明确影响化学反应速率的因素为解答关键,注意掌握化学反应速率的概念及表达式,试题培养了学生的化学实验、化学计算能力.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
2.请回答:
I.(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
II.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
(4)C与A形成的某一化合物能和C与B形成的另一无色化合物(这两种化合物分子中原子个数比皆为1:2)一起用作火箭助推剂,两者发生反应生成无毒物质,写出上述化学反应方程式:2N2H4+N2O4═3N2+4H2O.
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3..
I.(1)将硫化钠溶液与氯化铝溶液混合,有白色沉淀和气体生成,但此沉淀不是硫化铝.写出该反应的离子反应方程式:2Al3++3S2-+6H2O═2Al(OH)3↓+3H2S↑.
(2)将NH3通过灼热的CuO,有无色无味的难溶于水的气体生成,写出该反应的化学方程式:2NH3+3CuO$\frac{\underline{\;\;△\;\;}}{\;}$3Cu+N2+3H2O.
(3)CoCl2常用作多彩水泥的添加剂,可用钴的某种氧化物与盐酸反应制备(其中Co的化合价为+2、+3).现取适量这种钴的氧化物,可与480mL 5mol•L-1盐酸恰好完全反应,得到CoCl2溶液和6.72L黄绿色气体(标准状况).则该反应的化学反应方程式为Co3O4+8HCl═3CoCl2+Cl2↑+4H2O.
II.下表给出五种元素的相关信息,其中A、B、C、D为短周期元素.根据以下信息填空:
| 元素 | 相关信息 |
| A | 在常温、常压下,其单质是气体,随着人类对环境的认识和要求的提高,它将成为备受青睐的清洁燃料 |
| B | 工业上通过分离液态空气获得其单质,其某种同素异形体是保护地球地表环境的重要屏障 |
| C | 植物生长三要素之一,它能形成多种氧化物,其中一种是早期医疗中使用的麻醉剂 |
| D | 室温下其单质为淡黄色粉末状固体,加热易熔化.该单质在氧气中燃烧,发出明亮的蓝紫色火焰 |
| E | 它在地壳中储量丰富,是人体不可缺少的微量元素之一.其单质为银白色固体,是工农业生产中不可或缺的金属材料,常用于机械制备、建筑等行业 |
(5)化合物X是元素D的最高价氧化物的水化物,X在水中的电离方程为H2SO4═2H++SO42-;常温下,E的单质与化合物X稀溶液反应生成盐Y,Y的化学式是FeSO4.化合物Z仅由元素D和E组成,Z+H2O+O2→X+Y,产物中n(X):n(Y)=1:1,写出并配平上述方程式:2FeS2+2H2O+7O2═2FeSO4+2H2SO4.
(6)盐Y受强热会发生分解反应,其气体产物由元素D的氧化物组成,请设计一个可行的定性实验,验证其气体产物中所含元素D的氧化物的组成将气体产物通入品红溶液,如果品红溶液褪色,则含有SO2,反之则无SO2.取适量吸收液于试管,滴加适量盐酸酸化,再滴加BaCl2,如有白色沉淀生成,则含有SO3,反之则无SO3..
3.下列有关物质性质的应用正确的是( )
| A. | 氢氧化铝是白色胶状沉淀,能凝聚水中的悬浮物,但不能吸附色素 | |
| B. | 不慎将浓碱溶液沾到皮肤上,要立即用大题水冲洗,然后涂上硼酸 | |
| C. | 氮气化学性质通常不活泼,可将炽热的镁粉可放在氮气中冷却 | |
| D. | 酒精灯着火时可用水扑灭 |
20.硫代硫酸钠可作为脱“氯”剂,已知25.0mL 0.100mol/L Na2S2O3溶液恰好把0.01mol Br2完全转化为Br-离子,则S2O32-将转化成( )
| A. | S2- | B. | S | C. | SO32- | D. | SO42- |
7.已知R-X+2Na+R′-X→R-R′+2NaX,若用CH3CH2Br和  的混合物与金属钠反应,生成的烷烃不可能是( )
的混合物与金属钠反应,生成的烷烃不可能是( )
 的混合物与金属钠反应,生成的烷烃不可能是( )
的混合物与金属钠反应,生成的烷烃不可能是( )| A. | CH3CH2CH2CH3 | B. | CH3CH2CH2CH2CH3 | C. | (CH3)2CHCH2CH2CH3 | D. | CH3CH2CH(CH3)2 |
4.下列有关氯的叙述正确的是( )
| A. | 有大量的氯气泄漏时,用肥皂水浸湿软布蒙面,并迅速离开现场 | |
| B. | 氢气在盛有氯气的集气瓶中燃烧,瓶口有白烟产生 | |
| C. | 氯气能与铁反应,液氯不宜贮存在钢瓶中 | |
| D. | 工业上以氯气和澄清石灰水为原料制造漂白粉 |
