题目内容
6.下列物质按照混合物、非电解质、碱、酸式盐的顺序排列正确的是( )| A. | 漂白粉、Cl2、氨水、NaHCO3 | B. | 福尔马林、苯、Cu2(OH)2CO3、明矾 | ||
| C. | 盐酸、SO2、纯碱、NH4Cl | D. | 食醋、C2H5OH、苛性钾、NaHSO4 |
分析 混合物是由两种或多种物质混合而成的物质;
非电解质是指在水溶液里和熔化状态下都不能够导电的化合物,电解质是指在水溶液里或熔化状态下能够导电的化合物;
碱是电离时生成的阴离子都是氢氧根离子的化合物;
酸式盐电离时除了电离出金属离子和酸根离子外,还电离出氢离子,正盐是电离时只电离出金属离子和酸根离子的化合物.
解答 解:A.漂白粉中含有氯化钙、次氯酸钙,属于混合物,Cl2是单质,不是非电解质,氨水是氨气的水溶液,是混合物,不属于碱,NaHCO3是碳酸的酸式盐,故A错误;
B.福尔马林是甲醛的水溶液,属于混合物,苯是非电解质,Cu2(OH)2CO3是碱式盐,明矾属于正盐,故B错误;
C.盐酸是HCl的水溶液,属于混合物,SO2是非电解质,纯碱是碳酸钠,属于盐,NH4Cl也属于盐,故C错误;
D.食醋是乙酸的水溶液,属于混合物,C2H5OH是非电解质,苛性钾是碱,NaHSO4是硫酸的酸式盐,故D正确,
故选D.
点评 本题考查了常见物质的类别,明确酸、碱、盐、氧化物、电解质与非电解质等概念是解题的关键,题目难度不大,注意化学俗称的积累.

练习册系列答案
相关题目
19.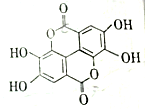 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
 二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )
二缩双是一种广泛存在于各种软果、坚果等植物组织中的天然组分,其结构简式如图,二缩双在稀硫酸作用下水解不能得到的产物的类别是( )| A. | 酚 | B. | 醛 | C. | 芳香族化合物 | D. | 羧酸 |
14.下面为测定稀盐酸与稀NaOH溶液反应的中和热的实验.
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
已知盐酸溶液的物质的量浓度为1.0mol•L-1,NaOH溶液的物质的量浓度为1.1mol•L-1,密度近似为1.00g•cm-3,中和后混合液的比热容c=4.18×10-3kJ•g-1•℃-1,则该反应的中和热为△H=-56.0kJ/mol.
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
(1)若因为反应中有放热现象,而造成少量HCl在反应中挥发,则测得的中和热偏小(填“偏大”“偏小”或“不变”).
(2)该实验小组做了三次实验,每次取溶液各50mL,并记录如表原始数据.
| 实验 序号 | 起始温度t1/℃ | 终止温度 (t2)/℃ | 温差 (t2-t1)/℃ | ||
| 盐酸 | NaOH溶液 | 平均值 | |||
| 1 | 25.1 | 24.9 | 25.0 | 31.6 | 6.6 |
| 2 | 25.1 | 25.1 | 25.1 | 31.8 | 6.7 |
| 3 | 25.1 | 25.1 | 25.1 | 31.9 | 6.8 |
(3)若用等浓度的醋酸与NaOH溶液反应,则测得的中和热的数值会偏小(填“偏大”“偏小”或“不变”),其原因是醋酸为弱酸,电离过程为吸热过程.
(4)在中和热测定实验中存在用水洗涤温度计上的盐酸溶液的步骤,若无此操作步骤,则测得的中和热的数值偏小(填“偏大”“偏小”或“不变”).
11.对于化学反应方向的确定,下列说法正确的是( )
| A. | 在温度、压强一定的条件下,焓因素和熵因素共同决定一个化学反应的方向 | |
| B. | 温度、压强一定时,吸热的熵增反应一定能够自发进行 | |
| C. | 反应焓变是决定反应能否自发进行的唯一因素 | |
| D. | 固体的溶解过程与熵变无关 |
18.设NA表示阿伏加德罗常数,下列说法正确的是( )
| A. | 80mL10mol/L的浓盐酸与足量MnO2反应,转移电子数为0.4 NA | |
| B. | 标准状况下,22.4LNO和11.2L氧气混合,气体的分子总数为1.5 NA | |
| C. | 7.2 g CaO2晶体中阴离子和阳离子总数为0.3 NA | |
| D. | 将1 mol NH4NO3溶于稀氨水中使溶液呈中性,溶液中NH4+数目为NA |
15.在新能源中,氢能将会成为21世纪最理想的能源,但现阶段氢气的主要用于合成氨工业
已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如表:
(1)H2燃烧的热化学方程式是2H2(g)+O2(g)=2H2O(l)△H=-571.6kJ/mol.
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
已知101kPa、25℃时,1mol下列物质完全燃烧生成稳定状态化合物时放出的热量数据如表:
| 物质 | 氢气 | 原煤 (主要成份是C) | 汽油 (主要成份C8H18) |
| 热量(kJ) | 285.8 | 250.9 | 4910 |
(2)工业上电解饱和盐水的副产物之一是H2,反应的离子方程式是2Cl-+2H2O$\frac{\underline{\;通电\;}}{\;}$2OH-+H2↑+Cl2↑.
16.有甲、乙、丙三种溶液,进行如下操作:
Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀完全溶解并产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液可能是( )
Na2CO3溶液$\stackrel{甲}{→}$白色沉淀$\stackrel{过量乙}{→}$沉淀完全溶解并产生气体$\stackrel{丙}{→}$产生白色沉淀
则甲、乙、丙三种溶液可能是( )
| A. | BaCl2、H2SO4、MgCl2 | B. | NaCl、HNO3、AgNO3 | ||
| C. | CaCl2、HNO3、NaCl | D. | BaCl2、HCl、Na2SO4 |
 现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.
现有稀硫酸、纯碱、二氧化碳、铜片、食盐、生石灰、铁片和木炭粉8种物质.