题目内容
 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.(1)砷(As)元素位于元素周期表第
1个黄砷(As4)分子中含有
(2)黑磷的结构与石墨相似.最近中国科学家将黑磷“撕”成了二维结构,硬度和导电能力都大大提高,这种二维结构属于
a.离子晶体 b.原子晶体 c.分子晶体 d.其它类型
(3)与硫元素的相关性质比,以下不能说明P的非金属性比S弱的是
a.磷难以与氢气直接化合 b.白磷易自燃 c.P-H的键能更小 d.H3PO4酸性更弱
(4)次磷酸钠(NaH2PO2)可用于化学镀镍,即通过化学反应在塑料镀件表面沉积镍-磷合金.
化学镀镍的溶液中含有Ni2+和H2PO2-,在酸性条件下发生以下镀镍反应:
①请配平上述化学方程式.
②上述反应中,若生成1mol H2PO3-,反应中转移电子的物质的量为
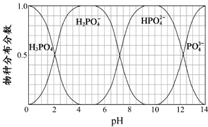
(5)NaH2PO4、Na2HPO4和Na3PO4可通过H3PO4与NaOH溶液反应获得,含磷各物种的分布分数(平衡时某物种的浓度占各物种浓度之和的分数)与pH的关系如图所示.
①pH=8时,溶液中主要含磷物种浓度大小关系为
②为获得尽可能纯的NaH2PO4,pH应控制在
考点:元素周期表的结构及其应用,物质的量浓度的相关计算,元素周期律的作用,不同晶体的结构微粒及微粒间作用力的区别,氧化还原反应方程式的配平
专题:计算题,元素周期律与元素周期表专题,化学键与晶体结构
分析:(1)砷(As)为第ⅤA族元素,As原子能量最高的3个轨道为4p,黄砷(As4)分子类似P4结构,为正四面体;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性;
(4)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(5)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;溶液中主要含磷物种浓度大小关系可由图表得出.
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性;
(4)镍元素的化合价降低了2价,磷元素的化合价升高的2价,根据原子守恒结合电荷守恒可得配平的方程式;
(5)为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间;溶液中主要含磷物种浓度大小关系可由图表得出.
解答:
解:(1)砷(As)为第ⅤA族元素,位于元素周期表第15列,As原子能量最高的3个轨道为4p,在空间相互垂直,黄砷(As4)分子类似P4结构,为正四面体,有6个As-As键,键角为60度,
故答案为:15;垂直;6;60;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同,存在共价键和分子间作用力,为混合型晶体,故答案为:d;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性,a、c、d均可比较,而b不能,故答案为:b;
(4)①镍元素的化合价降低了2价,磷元素的化合价升高的2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2-+1H2O═Ni+1H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
②1mol H2PO3-,反应中转移电子的物质的量为1mol×(4-2)=2mol,故答案为:2mol;
(5)①由图可知,pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-),故答案为:c(HPO42-)>c(H2PO4-);
②为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可),故答案为:4~5.5(介于此区间内的任意值或区间均可).
故答案为:15;垂直;6;60;
(2)黑磷的结构与石墨相似,硬度和导电能力都大大提高,则晶体类型与石墨相同,存在共价键和分子间作用力,为混合型晶体,故答案为:d;
(3)可利用与氢气化合的难易程度、N-H和P-H的键能及最高价含氧酸的酸性等比较非金属性,a、c、d均可比较,而b不能,故答案为:b;
(4)①镍元素的化合价降低了2价,磷元素的化合价升高的2价,由电子、电荷守恒及原子守恒可知,离子反应为Ni2++H2PO2-+1H2O═Ni+1H2PO3-+2H+,
故答案为:1;1;1H2O;1;1;2H+;
②1mol H2PO3-,反应中转移电子的物质的量为1mol×(4-2)=2mol,故答案为:2mol;
(5)①由图可知,pH=8时,溶液中主要含磷物种浓度大小关系为c(HPO42-)>c(H2PO4-),故答案为:c(HPO42-)>c(H2PO4-);
②为获得尽可能纯的NaH2PO4,pH应控制从图表中找出H2PO4-分布分数最大值所在区间,即4~5.5(介于此区间内的任意值或区间均可),故答案为:4~5.5(介于此区间内的任意值或区间均可).
点评:本题考查较综合,涉及元素在周期表的位置、晶体类型、氧化还原反应及图象分析等,综合考查学生分析问题、解决问题的能力,综合性较强,题目难度中等,注意类推法及信息的处理.

练习册系列答案
 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案
相关题目
下列各组离子在水溶液中能大量共存的是( )
| A、Na+、Fe3+、I-、CO32- |
| B、K+、Fe2+、Cl-、NO3- |
| C、H+、Na+、SiO32-、CH3COO- |
| D、Ag+、K+、Br-、NO3- |
下列说法正确的是( )
| A、向1 mo1?L-l CH3COOH溶液中加入少量CH3COONa固体,由于CH3COONa水解显碱性,所以溶液的pH升高 | ||||||||||
B、25℃时,将a mol?L-l氨水与0.01mol?L-1盐酸等体积混合,反应完全时溶液中c(NH4+)=c(Cl-),用含a的代数式表示反应完全时NH3?H2O的电离常数Kb=
| ||||||||||
C、根据表中数据可以计算出 (g)+3H2(g)→ (g)+3H2(g)→ (g)的焓变 (g)的焓变
| ||||||||||
| D、已知298K时,MgCO3的Ksp=6.82×10-6,溶液中c(Mg2+)=0.0001mol?L-1,c(CO32-)=0.0001mol?L-1,此时Mg2+和CO32-不能共存 |
描述或解释下列现象的离子方程式,正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、腐蚀法制作印刷线路板2Fe3++Cu═2Fe2++Cu2+ |
| C、碳酸氢铵溶液中加足量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
在生活、生产中为增大反应速率而采取的措施合理的是( )
| A、食物放在冰箱中 |
| B、塑料制品中添加抑制剂 |
| C、在糕点包装内放置小包除氧剂 |
| D、燃煤发电时用煤粉代替煤块 |
下列说法正确的是( )
| A、在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实.2CO2(g)+6H2(g)?CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应 | ||
B、室温下,将浓度为0.1mol?L?1HF溶液加水稀释,其电离平衡常数和
| ||
| C、电解精练铜时,阳极泥中常含有金属金、银、锌等 | ||
| D、锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除 |

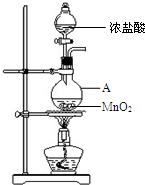 研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl. 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
