题目内容
描述或解释下列现象的离子方程式,正确的是( )
| A、Fe(OH)3溶于氢碘酸中:Fe(OH)3+3H+═Fe3++3H2O |
| B、腐蚀法制作印刷线路板2Fe3++Cu═2Fe2++Cu2+ |
| C、碳酸氢铵溶液中加足量石灰水:HCO3-+Ca2++OH-═CaCO3↓+H2O |
| D、用惰性电极电解熔融氯化钠:2Cl-+2H2O═Cl2↑+H2↑+2OH- |
考点:离子方程式的书写
专题:离子反应专题
分析:A.二者反应生成碘和亚铁离子;
B.二者反应生成亚铁离子、铜离子;
C.二者反应生成碳酸钙、一水合氨;
D.电解熔融氯化钠生成钠和氯气.
B.二者反应生成亚铁离子、铜离子;
C.二者反应生成碳酸钙、一水合氨;
D.电解熔融氯化钠生成钠和氯气.
解答:
解:A.二者反应生成碘和亚铁离子,离子方程式为6H++2Fe(OH)3+2I-=I2+2Fe2++6H2O,故A错误;
B.二者反应生成亚铁离子、铜离子,离子方程式为2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.二者反应生成碳酸钙、一水合氨,离子方程式为NH4++HCO3+Ca2++2OH-=CaCO3↓+NH3.H2O+H2O,故C错误;
D.电解熔融氯化钠生成钠和氯气,2NaCl
Cl2↑+2Na,故D错误;
故选B.
B.二者反应生成亚铁离子、铜离子,离子方程式为2Fe3++Cu═2Fe2++Cu2+,故B正确;
C.二者反应生成碳酸钙、一水合氨,离子方程式为NH4++HCO3+Ca2++2OH-=CaCO3↓+NH3.H2O+H2O,故C错误;
D.电解熔融氯化钠生成钠和氯气,2NaCl
| ||
故选B.
点评:本题考查了离子方程式的正误判断,题目难度中等,该题是高考中的高频题,解答本题关键是要明确判断离子方程式常用方法
(1)检查反应能否发生;
(2)检查反应物、生成物是否正确;
(3)检查各物质拆分是否正确;
(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);
易错选项是D,注意反应条件不同,其产物不同,为易错点.
(1)检查反应能否发生;
(2)检查反应物、生成物是否正确;
(3)检查各物质拆分是否正确;
(4)检查是否符合守恒关系(如:质量守恒和电荷守恒等);
易错选项是D,注意反应条件不同,其产物不同,为易错点.

练习册系列答案
相关题目
化学与生产和生活密切相关,下列说法正确的是( )
| A、误食重金属盐引起人体中毒,可喝大量的食盐水解毒 |
| B、变质的油脂有难闻的特殊气味,是由于油脂发生了水解反应 |
| C、浸泡过高锰酸钾溶液的硅藻土放于水果箱内是为了延长水果保鲜期 |
| D、安装煤炭燃烧过程的“固硫”装置,主要是为了提高煤的利用率 |
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、0.1mol乙烯和乙醇的混合物完全燃烧所消耗的O2一定为0.3NA |
| B、常温常压下,46g NO2与N2O4的混合气体中含有的分子总数为NA |
| C、25℃时,pH=13的Ba(OH)2溶液中含有OH-的数目为0.1NA |
| D、一定量的钠与8g氧气作用,若两者均无剩余,转移NA个电子 |
下列除杂操作可行的是( )
| A、通过浓硫酸除去HCl中的H2O |
| B、通过灼热的CuO除去H2中的CO |
| C、通过灼热的镁粉除去N2中的O2 |
| D、通过水除去CO中的CO2 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol N2与足量的H2反应,转移的电子数是0.6NA |
| B、常温下,0.1mol?L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C、常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA |
| D、2.24L CO和CO2的混合气体中所含的碳原子数为0.1N A |
化学与科技、生产、生活密切相关.下列说法不正确的是( )
| A、工业上,用焦炭在高温下还原二氧化硅制得粗硅 |
| B、“玉兔号”月球车太阳能电池帆板的材料是二氧化硅 |
| C、地沟油的主要成分是油脂,其组成与汽油、煤油不相同 |
| D、钠可把钛、锆、铌、钽等金属从它们的熔融的卤化物里还原出来 |
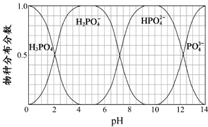 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.