题目内容
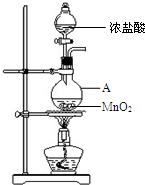 研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.
研究小组用下图装置制取Cl2,证明产生的气体中含有HCl.(1)仪器A的名称为
(2)甲同学将A中产生的气体通入下列溶液:
| 实验序号 | 试剂 | 现象 |
| a | 紫色石蕊溶液 | |
| b | AgNO3溶液 | 出现白色沉淀 |
②不能证明产生的气体中含有HCl的实验是
(3)已知将HCl气体通入饱和食盐水中有白色固体析出.乙同学将A中产生的气体通入饱和食盐水中,有白色固体析出,但该实验不能证明气体中含有HCl,结合化学用语解释其原因:
(4)已知:2S2O32-+I2═S4O62-+2I-.丙同学将A中产生的气体通入蒸馏水中,得到溶液X,进行以下实验证明气体中含有HCl.
I.测定X中溶解的Cl2.取25.00mL溶液X,加入过量KI溶液,然后用0.04mol?L-1 Na2S2O3溶液滴定生成
的I2,达滴定终点时消耗Na2S2O3溶液V mL.
Ⅱ.测定X中Cl元素总量.另取25.00mL溶液X,选用适当的还原剂将溶解的Cl2全部还原为Cl-,再用0.10mol?L-1 AgNO3溶液滴定所得溶液中的Cl-.
①X中的HClO不会影响I的测定结果,原因是
②由I、Ⅱ中实验数据可证明A中产生的气体中含有HCl,则Ⅱ中消耗0.10mol?L-1 AgNO3溶液的体积应大于
考点:氯气的实验室制法,氯、溴、碘的性质实验
专题:实验题
分析:(1)熟悉常见仪器,了解它们的名称和作用;实验室用二氧化锰与浓盐酸反应生成氯气;
(2)①氯气与水反应生成盐酸和次氯酸,盐酸和次氯酸电离产生氢离子,显酸性,次氯酸具有漂白性;
②氯气和水反应生成盐酸和次氯酸,盐酸电离能够产生氢离子和氯离子;
(3)氯气和水反应生成盐酸和次氯酸,盐酸电离出氯离子,使得溶液中的氯离子浓度增大,结合晶体的溶解平衡解答;
(4)①依据氧化还原反应得失电子守恒规律,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,相同物质的量的HClO和 Cl2均能将相同物质的量的 KI氧化成I2;
②依据2S2O32-~2I-~Cl2~2Cl-~2Ag+,计算出25.00mL溶液X溶解的Cl2全部还原为Cl-,消耗的硝酸银溶液的体积,若A中产生的气体中含有HCl,则需要的硝酸银应该比求出的体积大.
(2)①氯气与水反应生成盐酸和次氯酸,盐酸和次氯酸电离产生氢离子,显酸性,次氯酸具有漂白性;
②氯气和水反应生成盐酸和次氯酸,盐酸电离能够产生氢离子和氯离子;
(3)氯气和水反应生成盐酸和次氯酸,盐酸电离出氯离子,使得溶液中的氯离子浓度增大,结合晶体的溶解平衡解答;
(4)①依据氧化还原反应得失电子守恒规律,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,相同物质的量的HClO和 Cl2均能将相同物质的量的 KI氧化成I2;
②依据2S2O32-~2I-~Cl2~2Cl-~2Ag+,计算出25.00mL溶液X溶解的Cl2全部还原为Cl-,消耗的硝酸银溶液的体积,若A中产生的气体中含有HCl,则需要的硝酸银应该比求出的体积大.
解答:
解:(1)仪器A的名称为圆底烧瓶,分液漏斗中的浓盐酸和圆底烧瓶中的二氧化锰发生反应生成氯气、氯化锰、和水的离子方程式为:MnO2+4H++2Cl-
Cl2↑+2H2O+Mn2+,
故答案为:圆底烧瓶; MnO2+4H++2Cl-
Cl2↑+2H2O+Mn2+;
(2)①氯气和水反应生成盐酸和次氯酸,盐酸电离产生氢离子,溶液显酸性,所以紫色的石蕊试剂显红色,次氯酸具有漂白性,是变红的溶液褪色,所以现象为:先变红后褪色;
故答案为:先变红后褪色;
②氯气和水反应生成盐酸和次氯酸,盐酸电离能够产生氢离子和氯离子,溶液显酸性,氯离子遇到银离子产生白色沉淀,所以a、b都不能证明产生的气体中含有HCl;
故答案为:ab;
(3)氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出;
故答案为:Cl2+H2O HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
(4)①Cl2+H2O HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
故答案为:生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
②根据ⅠⅡ中给出的关系可知:
2S2O32-~2I-~Cl2~2Cl-~2Ag+,
2 2
0.04mol?L-1×V 0.10mol?L-1×V(AgNO3)
解得:V(AgNO3)=0.4Vml,
A中产生的气体中若是含有HCl,HCl也会与硝酸银反应,所以消耗的硝酸银溶液的体积应大于0.4Vml,
故答案为:0.4V.
| ||
故答案为:圆底烧瓶; MnO2+4H++2Cl-
| ||
(2)①氯气和水反应生成盐酸和次氯酸,盐酸电离产生氢离子,溶液显酸性,所以紫色的石蕊试剂显红色,次氯酸具有漂白性,是变红的溶液褪色,所以现象为:先变红后褪色;
故答案为:先变红后褪色;
②氯气和水反应生成盐酸和次氯酸,盐酸电离能够产生氢离子和氯离子,溶液显酸性,氯离子遇到银离子产生白色沉淀,所以a、b都不能证明产生的气体中含有HCl;
故答案为:ab;
(3)氯气和水反应生成盐酸和次氯酸,方程式为:Cl2+H2O
 HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,抑制了氯化钠的溶解,故也有晶体析出;故答案为:Cl2+H2O
 HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;
HCl+HClO,Cl2溶于水后使得溶液中的c(Cl-)增大,也能析出晶体;(4)①Cl2+H2O
 HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
HCl+HClO,生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;故答案为:生成1 mol HClO需消耗1 mol Cl2,HClO也有氧化性,1 mol HClO和1 mol Cl2均能将2 mol KI氧化成I2;
②根据ⅠⅡ中给出的关系可知:
2S2O32-~2I-~Cl2~2Cl-~2Ag+,
2 2
0.04mol?L-1×V 0.10mol?L-1×V(AgNO3)
解得:V(AgNO3)=0.4Vml,
A中产生的气体中若是含有HCl,HCl也会与硝酸银反应,所以消耗的硝酸银溶液的体积应大于0.4Vml,
故答案为:0.4V.
点评:本题考查氯气的性质和相关计算,题目难度中等,注意计算硝酸银溶液体积时,抓住各种物质之间的转化关系是解题的关键.

练习册系列答案
相关题目
下列除杂操作可行的是( )
| A、通过浓硫酸除去HCl中的H2O |
| B、通过灼热的CuO除去H2中的CO |
| C、通过灼热的镁粉除去N2中的O2 |
| D、通过水除去CO中的CO2 |
以下物质中存在12C、13C、14C原子的是( )
①金刚石 ②CO2 ③石灰石 ④葡萄糖.
①金刚石 ②CO2 ③石灰石 ④葡萄糖.
| A、①②③④ | B、①②③ |
| C、②③④ | D、②③ |
下列说法正确的是( )
| A、CH3CH2CH2CH3的二氯取代产物只有5种结构 |
| B、油脂的种类很多,但它们水解后都有一相同产物 |
| C、乙烯、苯、纤维素均属于烃类化合物 |
| D、苯和乙烯都能使溴水层褪色,均与溴水发生加成反应 |
 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.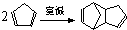 ,反应类型为
,反应类型为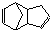 外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式
外,还有与双环戊二烯为同分异构体的其他副产物,写出其中一种的结构简式