题目内容
为测定某含有杂质Na2O的Na2O2样品的纯度,3个小组分别设计如下方案.首先准确称量样品mg,然后,按照以下方案进行实验,请你完成相关内容:
【方案一】:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量.
(1)Na2O2跟水反应的离子方程式是: ;
(2)根据所给数据计算出的试样中Na2O2含量的代数式为 .
【方案二】:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.
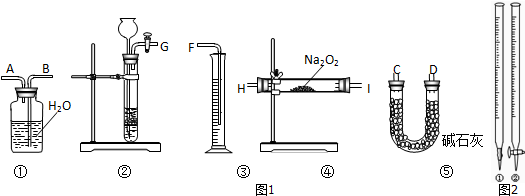
(1)图1是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是 .(填写仪器编号)
(2)装置①⑤的作用分别是:① ⑤ .
【方案三】:测定样品与水充分反应后溶液的体积VmL.,再从中取V1mL溶液装入锥形瓶中,用标准浓度的盐酸进行滴定,确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)方案中酸碱滴定时,选用的滴定管为图2中的 (填仪器编号).
(2)若用酚酞做指示剂,达到滴定终点时的现象为 .
【方案一】:将样品与水充分反应,使产生的O2通过灼热的铜粉,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量.
(1)Na2O2跟水反应的离子方程式是:
(2)根据所给数据计算出的试样中Na2O2含量的代数式为
【方案二】:将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量.

(1)图1是完成该实验可能用到的实验装置,根据此实验方案,实验所使用仪器的连接次序是
(2)装置①⑤的作用分别是:①
【方案三】:测定样品与水充分反应后溶液的体积VmL.,再从中取V1mL溶液装入锥形瓶中,用标准浓度的盐酸进行滴定,确定溶液的浓度,再计算出样品中Na2O2的含量.
(1)方案中酸碱滴定时,选用的滴定管为图2中的
(2)若用酚酞做指示剂,达到滴定终点时的现象为
考点:探究物质的组成或测量物质的含量
专题:实验探究和数据处理题
分析:方案一:过氧化钠和水反应生成氢氧化钠和氧气,氧气和铜反应生成氧化铜,测得反应后生成氧化铜的质量为ng,通过计算求出试样中Na2O2的含量;
方案二:(1)将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量,实验装置设计为先利用装置②制备二氧化碳,通过装置④和样品中过氧化钠反应,通过装置⑤除去过量的二氧化碳,利用①③采取排水量气方法测定生成氧气的体积;
(2)装置⑤是利用碱石灰除去氧气中过量的二氧化碳气体;
方案三:(1)此滴定实验是利用盐酸滴定氢氧化钠溶液,酸盛在酸式滴定管;
(2)酚酞做滴定指示剂,滴定终点溶液由红色突变为无色且半分钟内不恢复.
方案二:(1)将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量,实验装置设计为先利用装置②制备二氧化碳,通过装置④和样品中过氧化钠反应,通过装置⑤除去过量的二氧化碳,利用①③采取排水量气方法测定生成氧气的体积;
(2)装置⑤是利用碱石灰除去氧气中过量的二氧化碳气体;
方案三:(1)此滴定实验是利用盐酸滴定氢氧化钠溶液,酸盛在酸式滴定管;
(2)酚酞做滴定指示剂,滴定终点溶液由红色突变为无色且半分钟内不恢复.
解答:
解:方案一:(1)过氧化钠和水反应生成氢氧化钠和氧气,反应离子方程式为:2Na2O2+2H2O═4Na++4OH-+O2↑;
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(2)2Na2O2+2H2O═4Na++4OH-+O2↑;O2+2Cu
2CuO
2Na2O2~O2~2CuO
156 160
m(Na2O2) ng
m(Na2O2)=
ω(Na2O2)=
×100%=
×100%,故答案为:
×100%;
方案二:
(1)将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量,实验装置设计为先利用装置②制备二氧化碳,通过装置④和样品中过氧化钠反应,通过装置⑤除去过量的二氧化碳,利用①③采取排水量气方法测定生成氧气的体积,导管应短进长出;仪器的连接顺序为:②④⑤①③,
故答案为:②④⑤①③;
(2)装置⑤是利用碱石灰除去氧气中过量的二氧化碳气体,避免影响氧气的体积测定,装置①和③联合起来采取排水量气方法测定生成氧气的体积,
故答案为:排水法收集O2; 除去O2中混有的CO2气体(或CO2与HCl);
方案三:
(1)此滴定实验是利用盐酸滴定氢氧化钠溶液,标准溶液盐酸盛在酸式滴定管中进行滴定实验,故答案为:②;
(2)酚酞做滴定指示剂,当滴入最后1滴盐酸时,溶液由红色突变为无色且半分钟内不恢复,达到滴定终点,
故答案为:当滴入最后1滴盐酸时,溶液由红色突变为无色且半分钟内不恢复.
故答案为:2Na2O2+2H2O═4Na++4OH-+O2↑;
(2)2Na2O2+2H2O═4Na++4OH-+O2↑;O2+2Cu
| ||
2Na2O2~O2~2CuO
156 160
m(Na2O2) ng
m(Na2O2)=
| 156×ng |
| 160 |
ω(Na2O2)=
| ||
| m |
| 39n |
| 40m |
| 39n |
| 40m |
方案二:
(1)将样品与二氧化碳反应,通过测定反应产生氧气的体积,计算出样品中Na2O2的含量,实验装置设计为先利用装置②制备二氧化碳,通过装置④和样品中过氧化钠反应,通过装置⑤除去过量的二氧化碳,利用①③采取排水量气方法测定生成氧气的体积,导管应短进长出;仪器的连接顺序为:②④⑤①③,
故答案为:②④⑤①③;
(2)装置⑤是利用碱石灰除去氧气中过量的二氧化碳气体,避免影响氧气的体积测定,装置①和③联合起来采取排水量气方法测定生成氧气的体积,
故答案为:排水法收集O2; 除去O2中混有的CO2气体(或CO2与HCl);
方案三:
(1)此滴定实验是利用盐酸滴定氢氧化钠溶液,标准溶液盐酸盛在酸式滴定管中进行滴定实验,故答案为:②;
(2)酚酞做滴定指示剂,当滴入最后1滴盐酸时,溶液由红色突变为无色且半分钟内不恢复,达到滴定终点,
故答案为:当滴入最后1滴盐酸时,溶液由红色突变为无色且半分钟内不恢复.
点评:本题考查了物质性质的实验探究方法,装置连接是解题关键,掌握基础是关键,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
用石墨做电极电解饱和食盐水,阳极电极反应式为( )
| A、Na++e--=Na |
| B、2H++4e-=2H2 |
| C、2Cl--2e-=Cl2 |
| D、4OH--4e-=2H2O+O2 |
下列离子方程式书写不正确的是( )
| A、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | ||||
| B、含等物质的量的硫酸氢钠与氢氧化钡两溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | ||||
| C、用稀硝酸浸泡做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | ||||
D、用两个铜电极电解饱和食盐水:2Cl-+2H2O
|


 )与足量有机物D反应的化学方程式
)与足量有机物D反应的化学方程式

 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: 如图是干冰的晶胞结构示意图.请完成下列问题:
如图是干冰的晶胞结构示意图.请完成下列问题: