题目内容
配平下列化学方程式: P4O+ Cl2 → POCl3+ P2Cl6.
考点:氧化还原反应方程式的配平
专题:
分析:这是一个氧化还原反应,Cl、P的化合价都变了,确定P的化合价要先定下O和Cl的化合价.一般情况下O为-2,Cl为-1,然后根据化合价代数和为0.
P4O中P为+0.5价,POCl3中P为+5价,P2Cl6中P为+3价.此反应逆向配平,生成一个POCl3时,化合价总共升高1.5价,生成一个P2Cl6时,总共降低1价,公倍数为3(取整数),为使Cl2系数为整数,乘以2,得6,即POCl3为4(4×1.5=6),P2Cl6为6,观察法配平反应物系数.
P4O中P为+0.5价,POCl3中P为+5价,P2Cl6中P为+3价.此反应逆向配平,生成一个POCl3时,化合价总共升高1.5价,生成一个P2Cl6时,总共降低1价,公倍数为3(取整数),为使Cl2系数为整数,乘以2,得6,即POCl3为4(4×1.5=6),P2Cl6为6,观察法配平反应物系数.
解答:
解:此反应逆向配平,生成一个POCl3时,P化合价从+0.5变为+5,化合价升高了4.5价,氯从0价变为-1价,三个氯原子降低了3价,化合价总共升高1.5价,生成一个P2Cl6时,P化合价从+0.5变为+3,2个P化合价升高了5价,Cl化合价从0降为-1,6个氯共降低了6价,总共降低1价,公倍数为3(取整数),为使Cl2系数为整数,乘以2,得6.即POCl3为4(4×1.5=6),P2Cl6为6,观察法配平反应物系数,结果为:4P4O+24Cl2═4POCl3+6P2Cl6,故答案为:4;24;4;6.
点评:本题考查了化学方程式的配平,中等难度,注意从生成物开始配平,把生成物当成一个整体来配平.

练习册系列答案
 学练快车道快乐假期暑假作业新疆人民出版社系列答案
学练快车道快乐假期暑假作业新疆人民出版社系列答案 浙大优学小学年级衔接导与练浙江大学出版社系列答案
浙大优学小学年级衔接导与练浙江大学出版社系列答案 小学暑假作业东南大学出版社系列答案
小学暑假作业东南大学出版社系列答案
相关题目
25℃时,有关弱酸的电离平衡常数如下,则下列有关说法不正确的是( )
| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数 | 1.8×10-5 | 4.9×10-10 | K1=4.3×10-7 K2=5.6×10-11 |
| A、溶液酸性从大到小顺序为CH3COOH、H2CO3、HCN |
| B、碳酸电离方程式为H2CO3?2H++CO32- |
| C、25℃时,pH=5的CH3COOH溶液和pH=5的HCN 溶液中,后者浓度大 |
| D、温度相同时,相同浓度的NaHCO3和Na2CO3溶液的碱性,后者强 |
0.5L 1mol/L的FeCl3溶液与0.2L 1mol/L的KCl溶液中,Cl-浓度比为( )
| A、15:2 | B、1:2 |
| C、3:1 | D、1:3 |
下列离子方程式书写不正确的是( )
| A、碳酸氢铵和足量的氢氧化钠溶液反应:NH4++OH-=NH3↑+H2O | ||||
| B、含等物质的量的硫酸氢钠与氢氧化钡两溶液混合:H++SO42-+Ba2++OH-=BaSO4↓+H2O | ||||
| C、用稀硝酸浸泡做过银镜反应的试管:3Ag+4H++NO3-=3Ag++NO↑+2H2O | ||||
D、用两个铜电极电解饱和食盐水:2Cl-+2H2O
|
在25℃时,密闭容器中X、Y、Z三种气体的初始浓度和平衡浓度如表:下列说法错误的是( )
| 物质 | X | Y | Z |
| 初始浓度(mol/L) | 0.1 | 0.2 | 0 |
| 平衡浓度(mol/L) | 0.05 | 0.05 | 0.1 |
| A、反应达到平衡时,X的转化率为50% |
| B、反应可表示为X(g)+3Y(g)?2Z(g) |
| C、增大压强可使平衡向生成Z的方向移动,平衡常数增大 |
| D、改变温度可以改变此反应的平衡常数 |
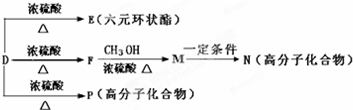


 )与足量有机物D反应的化学方程式
)与足量有机物D反应的化学方程式

 下面给出了四种烃A、B、C、D的相关信息:
下面给出了四种烃A、B、C、D的相关信息: 利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2,其它条件相同的情况下,使用不同催化剂(Ⅰ,Ⅱ,Ⅲ),CH4的产量随光照时间的变化如图所示.
利用光能和光催化剂,可将CO2和H2O(g)转化为CH4和O2,其它条件相同的情况下,使用不同催化剂(Ⅰ,Ⅱ,Ⅲ),CH4的产量随光照时间的变化如图所示.