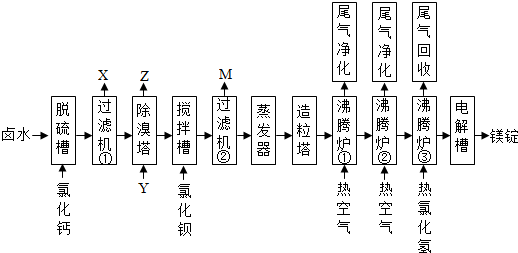
题目内容
1.设NA为阿伏加德罗常数的值,下列叙述正确的是( )| A. | 标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,转移电子数为0.2NA | |
| B. | 标准状况下,22.4 L由CO和N2组成的混合气体中含有2NA个原子 | |
| C. | 一定量的浓H2SO4与0.1 mol Mg恰好完全反应,生成的SO2分子数一定为0.1NA | |
| D. | 1.6 g-NH2和1.5 g-CH3含有的电子数均为NA |
分析 A.铜与氯气反应生成氯化铜;
B.根据标况下的气体摩尔体积计算出混合气体的物质的量结合CO和N2都是双原子分子;
C.浓硫酸与镁反应生成二氧化硫,稀硫酸与镁反应生成氢气;
D.质量转化为物质的量,结合1个-NH2含有9个电子,1个-CH3含有9个电子;
解答 解:A.标准状况下,0.1 mol铜粉在1.12 L氯气中充分燃烧,氯气不足,转移电子数为0.05mol×2=0.1NA,故A错误;
B.标况下,22.4L一氧化碳和二氧化碳的物质的量为1mol,CO和N2都是双原子分子,共含有2NA个原子,故B正确;
C.一定量的浓H2SO4与0.1 mol Mg恰好完全反应,因浓硫酸量不确定,所以生成的二氧化硫分子数可能为0.1mol,也可能小于0.1mol,故C错误;
D.1.6 g-NH2物质的量为$\frac{1.6g}{16g/mol}$=0.1mol,含有电子数为0.9mol,含有的电子数均0.9NA,1.5 g-CH3物质的量为$\frac{1.5g}{15g/mol}$=0.1mol,含有的电子数均0.9NA,故D错误;
故选:B.
点评 本题考查阿伏加德罗常数的有关计算和判断,掌握好以物质的量为中心的各化学量与阿伏加德罗常数的关系,准确弄清分子、原子、原子核内质子中子及核外电子的构成关系是解题关键,题目难度中等.

练习册系列答案
 探究与巩固河南科学技术出版社系列答案
探究与巩固河南科学技术出版社系列答案
相关题目
12.化学与社会、生活密切相关.下列现象或事实及对应解释正确的是( )
| 选项 | 现象或事实 | 解释 |
| A | 可用铁制容器储存、运输浓硫酸 | 常温下铁与浓硫酸不反应 |
| B | 可用二氧化硫漂白纸浆、草帽等 | 二氧化硫具有氧化性 |
| C | 可用碳酸钠溶液将水垢中的硫酸钙转化为碳酸钙 | Ksp(CaSO4)>Ksp(CaCO3) |
| D | 福尔马林常用来保存新鲜食品 | 福尔马林具有杀菌防腐性能 |
| A. | A | B. | B | C. | C | D. | D |
9.NA为阿伏加德罗常数,下列叙述正确的是( )
| A. | 18gH216O和20gH218O含有的质子数均为10NA | |
| B. | 1L1mol/L的KAl(SO4)2溶液中阳离子总数为2NA | |
| C. | 0.2mol的铁与足量的稀硝酸反应,生成氢气的分子数目为0.3NA | |
| D. | 反应N2+3H2═2NH3达平衡时,每消耗3molH2同时有2NA个N-H断裂 |
6.Li-Al/FeS电池是某科研机构正在研发的一种车载电池,该电池中正极的电极反应式为:2Li++FeS+2e-═Li2S+Fe.有关该电池的下列说法正确的是( )
| A. | Li-Al在电池中作为负极材料,该材料中Li的化合价为+l价 | |
| B. | 用水作电解质溶液 | |
| C. | 该电池的电池反应式为:2Li+FeS═Li2S+Fe | |
| D. | 充电时,阴极发生的电极反应式为:Li2S+Fe-2e-═2Li++FeS |
13.油酸甘油酯(相对分子质量884)在体内代谢时可发生如下反应:
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热△H为( )
C57H104O6(s)+80O2(g)=57CO2(g)+52H2O(l)
已知燃烧1kg该化合物释放出热量3.8×104kJ,油酸甘油酯的燃烧热△H为( )
| A. | 3.8×104kJ•mol-1 | B. | -3.8×104kJ•mol-1 | ||
| C. | 3.4×104kJ•mol-1 | D. | -3.4×104kJ•mol-1 |
1.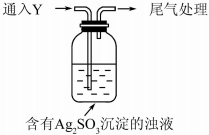 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-,Ag+.
(2)调节pH,实验记录如下:
查阅资料得知:
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为4Ag++2SO32-+O2=2Ag2SO4↓.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是证明不是氧化银.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O═2Ag+H2SO4.
 某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.
某学生对Na2SO3与AgNO3在不同pH下的反应进行探究.(1)测得Na2SO3溶液pH=10,AgNO3溶液pH=5,二者发生水解的离子分别是SO32-,Ag+.
(2)调节pH,实验记录如下:
| 实验 | pH | 现象 |
| A | 10 | 产生白色沉淀,稍后溶解,溶液澄清 |
| B | 6 | 产生白色沉淀,一段时间后,沉淀未溶解 |
| C | 2 | 产生大量白色沉淀,一段时间后,产生海绵状棕黑色物质X |
①Ag2SO3:白色,难溶于水,溶于过量Na2SO3的溶液
②Ag2O:棕黑色,不溶于水,能和酸反应,它和盐酸反应的化学方程式为:Ag2O+2HCl=2AgCl+H2O.
(3)该同学推测a中白色沉淀为Ag2SO4,依据是空气中的氧气可能参与反应,则生成硫酸银沉淀的离子方程式为4Ag++2SO32-+O2=2Ag2SO4↓.
该同学设计实验确认了a、b、c中的白色沉淀不是Ag2SO4,实验方法是:取b、c中白色沉淀,置于Na2SO3溶液中,沉淀溶解.另取Ag2SO4固体置于足量Na2SO3溶液中,未溶解.
(4)将c中X滤出、洗净,为确认其组成,实验如下:
I.向X中滴加稀盐酸,无明显变化
Ⅱ.向X中加入过量浓HNO3,产生红棕色气体
Ⅲ.用Ba(NO3)2溶液、BaCl2溶液检验Ⅱ中反应后的溶液,前者无变化,后者产生白色沉淀.
①实验I的目的是证明不是氧化银.
②根据实验现象,分析X是Ag.
③Ⅱ中反应的化学方程式是Ag+2HNO3(浓)=AgNO3+NO2↑+H2O.
(5)该同学综合以上实验,分析产生X的原因,认为随着酸性的增强.+4价硫的还原性增强,能被+1价银氧化.通过进一步实验确认了这种可能性,实验如下:
①通入Y后,瓶中白色沉淀转化为棕黑色,气体Y是SO2.
②白色沉淀转化为X的化学方程式是Ag2SO3+H2O═2Ag+H2SO4.
 如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
如图各物质是中学化学中常见的物质,甲、乙均是离子化合物,且阴、阳离子个数比为1:1.甲是发酵粉的主要成分,乙是一种常用的化肥.B、D常温常压下是气体.请回答下列问题:
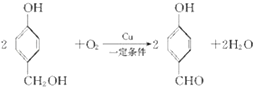 ;
;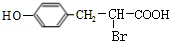 ;
;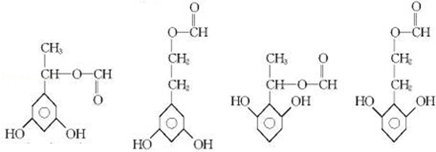 任意2种(任写两种).
任意2种(任写两种).