题目内容
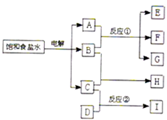 如图所示,每一方框中的字母各代表一种反应物或生成物:
如图所示,每一方框中的字母各代表一种反应物或生成物:物质A跟B反应生成物质E、F和G;物质C跟D在2L的反应容器中生成物质I,某温度下该反应起始时刻试剂的反应混合物组成如下表格所示,且D、I在常温下均为气体,
| C | D | I | |
| 起始组成/mol | 6 | 4 | 0 |
| 平衡组成/mol | 3 | 3 | 1 |
| A、物质H的化学式是HCl | ||
| B、反应①的化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O | ||
C、反应②的平衡常数等于
| ||
| D、电解饱和食盐水的阴极可以是铁棒,阳极可以是碳棒或铁棒 |
考点:无机物的推断,化学平衡的计算
专题:推断题,化学平衡专题
分析:电解饱和食盐水生成Cl2、H2和NaOH,其中Cl2和NaOH反应生成NaClO、NaCl和H2O三种物质,而Cl2和H2反应只生成HCl,由框图可知A为NaOH,B为Cl2,C为H2,由表中数据可知n(H2):n(D):n(I)=3:1:2,由质量守恒定律可知,D为双原子分子,1molI中含有3molH和1molD,且D、I在常温下均为气体,则I应为NH3,则D为N2,以此进行解答.
解答:
解:电解饱和食盐水生成Cl2、H2和NaOH,其中Cl2和NaOH反应生成NaClO、NaCl和H2O三种物质,而Cl2和H2反应只生成HCl,由框图可知A为NaOH,B为Cl2,C为H2,由表中数据可知n(H2):n(D):n(I)=3:1:2,由质量守恒定律可知,D为双原子分子,1molI中含有3molH和1molD,且D、I在常温下均为气体,则I应为NH3,则D为N2,
A.由上述分析可知,物质H的化学式是HCl,故A正确;
B.反应①是氯气与氢氧化钠溶液反应,化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O,故B正确;
C.反应②为N2+3H2?2NH3,平衡常数为=
=
,故C正确;
D.Fe为活性电极,电解饱和食盐水,若Fe为阳极,不能得到氯气,故D错误,
故选D.
A.由上述分析可知,物质H的化学式是HCl,故A正确;
B.反应①是氯气与氢氧化钠溶液反应,化学方程式是Cl2+2NaOH═NaCl+NaClO+H2O,故B正确;
C.反应②为N2+3H2?2NH3,平衡常数为=
(
| ||||
|
| 4 |
| 81 |
D.Fe为活性电极,电解饱和食盐水,若Fe为阳极,不能得到氯气,故D错误,
故选D.
点评:本题考查无机物推断、化学平衡常数计算、电解原理等,难度中等,注意根据Cl2和NaOH的反应成物的种类判断.

练习册系列答案
 课堂全解字词句段篇章系列答案
课堂全解字词句段篇章系列答案 步步高口算题卡系列答案
步步高口算题卡系列答案 点睛新教材全能解读系列答案
点睛新教材全能解读系列答案
相关题目
某溶液中存在大量的H+、SO42-、Cl-,该溶液中还可能大量存在的离子是( )
| A、OH- |
| B、NO3- |
| C、Ag+ |
| D、Ba2+ |
下列叙述正确的是( )
| A、钠和水反应放出氢气 |
| B、钠与硫的化合反应属于吸热反应 |
| C、钠在空气中燃烧生成Na2O |
| D、钠的密度比相同条件下的钾的密度小 |
 中国短道速滑队在索契冬奥会取得了骄人的成绩.速滑冰刀可用特种不锈钢制成,不锈钢含有的主要元素是( )
中国短道速滑队在索契冬奥会取得了骄人的成绩.速滑冰刀可用特种不锈钢制成,不锈钢含有的主要元素是( )| A、铁 | B、碳 | C、铜 | D、铝 |
由乙醛和乙酸乙酯组成的混合物中,若含碳的质量分数为A%,则此混合物中含氢的质量分数为( )
| A、6A% | ||
B、
| ||
| C、10A% | ||
D、(100-
|
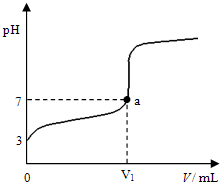 某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )
某温度下向20mL 0.1mol?L-1 CH3COOH溶液中逐滴加入0.1mol?L-1 NaOH溶液,混合液的pH随NaOH溶液的体积(V)的变化关系如图(忽略温度变化).下列说法中正确的是( )| A、该温度下醋酸的电离平衡常数约为1×10-5mol?L-1 |
| B、图中V1>20mL,且a点对应的溶液中:c (Na+)+c (H+)=c (OH-)+c (CH3COO-) |
| C、图中V1<20mL,且a点对应的溶液中:c (CH3COOH)+c (CH3COO-)>c (Na+) |
| D、当加入NaOH溶液的体积为20mL时,溶液中:c (CH3COOH)+c (H+)>c (OH-) |
关于化学键的叙述中,正确的是( )
| A、HCl电离产生H+和Cl-,可判断HCl分子中存在离子键 |
| B、Na2O2固体中含有的阴离子与阳离子的个数比为1:1 |
| C、化学键是指使原子或离子相互结合的作用力 |
| D、不同元素组成的多原子分子中的化学键一定全是极性键 |
