题目内容
17.生活用水的净化、消毒杀菌处理与生产、生活废水的无害化处理与我们的生活密切相关,回答下列问题.(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是暂时硬度 水,除去水垢中CaSO4的试剂是纯碱、盐酸,写出除去CaSO4的离子反应方程式CaSO4+CO32-=CaCO3+SO42-、CaCO3+2H+=Ca2++H2O+CO2↑.
(2)K2FeO4是一种新型的水处理剂,它兼有消毒杀菌、净水双重功能,具有消毒杀菌功能是因为它有高铁酸钾有强氧化 性.但若水的酸性或碱性较强,该试剂的净水功能均会减弱甚至消失,原因是当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体.
(3)图1是离子交换柱结构示意图,则左侧的是阳 (填阴或阳)离子交换柱.硬度为1毅的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO)的水.若某天然水中其它离子转化后相当于有c(Ca2+)=1.0×10-3 mol/L,此水是否符合我国饮用水的硬度标准为符合,1.0×10-3mol/L×56g/mL×103mg/g×1L=56mg/L<450mg/L (生活用水卫生标准规定,总硬度不超过450mg/L,写出计算式).
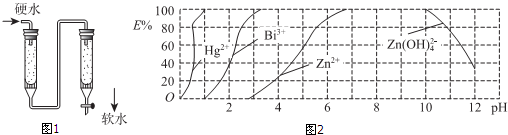
(4)用双硫腙(H2Dz)~CC14络合萃取法可从工业废水中提取金属离子:H2Dz先将金属离子络合成电中性的物质[如Hg(HDz)2等],再用CCl4萃取此络合物.图2是用上述方法处理含有Hg2+、Bi3+、Zn2+的废水时的酸度曲线(E%表示金属离子以络合物形式被萃取分离的百分率).
①当废水的pH=4时,废水中能以简单金属离子形式存在的离子是Zn2+.
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,废水的pH=2.
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-.
分析 (1)具有暂时硬度的水经加热煮沸后,钙、镁离子转化为沉淀;CaSO4与纯碱碳酸钠发生复分解生成难溶的碳酸钙沉淀;碳酸钙与盐酸反应生成氯化钙、二氧化碳和水;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性;当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
(3)硬水转化为软水,所以是阳离子交换柱;依据硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO),将水中的Ca2+、Mg2+质量折算成CaO的质量计算得到;
(4)①由图可知:当废水的pH=4时,废水中能以简单金属离子形式存在的离子是锌离子;
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,也就是属离子以络合物形式被萃取分离的百分率为40%,对就废水的pH=2;
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-.
解答 解:(1)暂时硬度水与永久硬度水煮沸后会出现白色固体的是暂时硬度;CaSO4与纯碱碳酸钠发生的离子方程式为:CaSO4+CO32-=CaCO3+SO42-;碳酸钙与盐酸反应生成氯化钙、二氧化碳和水的离子反应方程式为:CaCO3+2H+=Ca2++H2O+CO2↑,故答案为:暂时硬度;CaSO4+CO32-=CaCO3+SO42-;CaCO3+2H+=Ca2++H2O+CO2↑,;
(2)K2FeO4具有强氧化性,可用于杀菌消毒,可生成Fe(OH)3,具有吸附性,可除去水的悬浮性杂质,当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
故答案为:高铁酸钾有强氧化;当水的酸性或碱性较强时均不利于形成Fe(OH)3胶体;
(3)硬水转化为软水,所以是阳离子交换柱;某天然水中c(Ca2+)=1×10-3mol•L-1硬度为1°的水是指每升水含10mgCaO或与之相当的物质(如7.1mgMgO);1L水中钙离子物质的量=1×10-3mol,相当于CaO质量=1×10-3mol×56g/mol=56mg/L<450mg/L,故答案为:阳;符合,1.0×10-3mol/L×56g/mL×103mg/g×1L=56mg/L<450mg/L;
(4)①由图可知:当废水的pH=4时,废水中能以简单金属离子形式存在的离子是锌离子,故答案为:Zn2+;
②当水中n(Bi3+):n[Bi(HDz)3]=3:2时,也就是属离子以络合物形式被萃取分离的百分率为40%,对就废水的pH=2,故答案为:2;
③向萃取后的CCl4中加入NaOH溶液可将铋元素以氢氧化物的形式沉淀下来,相应的离子方程式为Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-,故答案为:Bi(HDz)3+6OH-=Bi(OH)3↓+3H2O+3Dz2-.
点评 本题主要考查了学生分析问题、解决问题的能力,紧扣习题中的信息是解答本题的关键,难度中等.

| A. | 比例模型 可以表示二氧化碳分子 可以表示二氧化碳分子 | |
| B. | S2-的结构示意图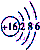 | |
| C. | 电子式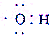 可以表示羟基,也可以表示氢氧根离子 可以表示羟基,也可以表示氢氧根离子 | |
| D. | 光气((COCl2)结构式: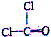 |
| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
| A. | (NH4)2SO4和CuSO4溶液都能使蛋白质沉淀析出 | |
| B. | 苯酚与甲醛在酸性条件下生成酚醛树脂的结构简式为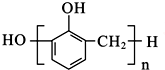 | |
| C. | 醋酸和硬脂酸互为同系物,C6H12和C9H18也一定互为同系物 | |
| D. | 迷迭香酸的结构为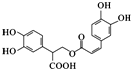 它可以发生酯化、水解但不能加成反应. 它可以发生酯化、水解但不能加成反应. |
| A. | 气态氢化物的稳定性:HX>H2Y>ZH3 | B. | 非金属活泼性:Y<X<Z | ||
| C. | 原子半径:X>Y>Z | D. | 原子最外层电子数:Z>Y>X |
| A. | 石墨 | B. | 液态HCl | C. | 葡萄糖 | D. | 熔融的Na2CO3 |
 ,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
,N2F2分子中N原子的杂化方式是sp2,1mol N2F2含有1.806×1024个σ键.
 ;加聚反应;
;加聚反应;