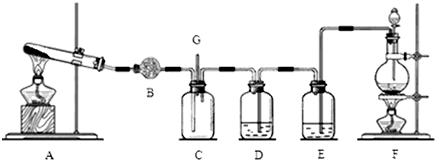
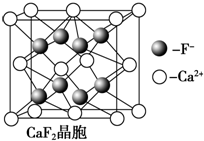
题目内容
5.下列离子方程式正确的是( )| A. | NaHCO3溶液与稀H2SO4反应:CO32-+2H+═H2O+CO2↑ | |
| B. | 向20mL1mol/L的FeBr2溶液中通入0.02molCl2:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl- | |
| C. | 向漂白粉溶液中通入少量的SO2:SO2+Ca2++2ClO-+H2O═CaSO3↓+2HClO | |
| D. | 单质钠与CuSO4溶液反应:2Na+Cu2+═Cu+2Na+ |
分析 A.碳酸氢根离子为弱酸根离子不能拆;
B.二价铁离子还原性强于溴离子,氯气先氧化二价铁离子,剩余氯气再氧化溴离子;
C.次氯酸根离子具有强的氧化性,能够氧化二氧化硫生成硫酸根离子;
D.不符合反应客观事实.
解答 解:A.NaHCO3溶液与稀H2SO4反应,离子方程式:HCO3-+H+═H2O+CO2↑,故A错误;
B.向20mL1mol/L的FeBr2溶液中通入0.02molCl2,离子方程式:2Fe2++2Br-+2Cl2═2Fe3++Br2+4Cl-,故B正确;
C.向次氯酸钙溶液中通入少量SO2的离子反应为:Ca2++2ClO-+H2O+SO2═CaSO4↓+H++Cl-+HClO,故C错误;
D.钠与硫酸铜溶液反应生成氢氧化铜沉淀,和硫酸钠、水,得不到铜,评价错误,故D错误;
故选:B.
点评 本题考查了离子方程式和化学方程式的书写,掌握反应原理是解答本题的关键,注意离子反应遵循客观事实,题目难度不大.

练习册系列答案
相关题目
16.氯化亚铜(CuCl)常用作有机合成工业中的催化剂,在空气中迅速被氧化成绿色;见光则分解,变成褐色.如图是工业上用制作印刷电路的废液(含Fe3+、Cu2+、Fe2+、Cl-)生产CuCl的流程:

根据以上信息回答下列问题:
(1)生产过程中X的化学式为Fe.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.实际生产中SO2要适当过量,原因可能是提高Cu2+的还原速率,同时可以防止生成的Cu+被空气氧化(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
析出CuCl晶体最佳pH为2,当pH较大时CuCl产率变低原因是Cu2+水解程度增大,反应生成CuCl减少,产率减小.调节pH时,不能(填“能”或“不能”)用相同pH的硝酸代替硫酸,理由是硝酸会与产品CuCl发生反应.
(5)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
则样品中CuCl的纯度为95.5%(结果保留三位有效数字).

根据以上信息回答下列问题:
(1)生产过程中X的化学式为Fe.
(2)写出产生CuCl的化学方程式:CuCl2+CuSO4+SO2+2H2O=2CuCl↓+2H2SO4.
(3)在CuCl的生成过程中理论上不需要补充SO2气体,结合化学方程式和必要的文字说明理由Cu+2 H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CuSO4+SO2↑+2H2O反应中生成的CuSO4和 SO2为1:1,所以理论上不需要补充SO2气体.实际生产中SO2要适当过量,原因可能是提高Cu2+的还原速率,同时可以防止生成的Cu+被空气氧化(答一点即可).
(4)实验探究pH对CuCl产率的影响如下表所示:
| pH | 1 | 2 | 3 | 4 | 5 | 6 | 7 |
| CuCl产率/% | 70 | 90 | 82 | 78 | 75 | 72 | 70 |
(5)氯化亚铜的定量分析:
①称取样品0.25g和过量的FeCl3溶液于锥形瓶中,充分溶解.
②用0.10mol•L-1硫酸铈标准溶液滴定.已知:CuCl+FeCl3═CuCl2+FeCl2、Fe2++Ce4+═Fe3++Ce3+.三次平行实验结果如下(平行实验结果相差不能超过1%):
| 平行实验次数 | 1 | 2 | 3 |
| 0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
10.消除氮氧化物和硫氧化物有助于预防雾霾天气的形成.
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
①0~10min内,NO的平均反应速率v(NO)=0.06mol/(L•min),该温度下反应的平衡常数K=0.5625.
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.
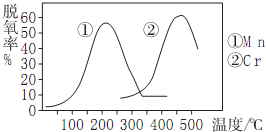
②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
(1)某恒容密闭容器中存在如下反应:C(s)+2NO(g)?N2(g)+CO2(g)△H.维持温度不变,测得不同时刻几种气体物质的浓度如下表所示:
| 时间(min) 浓度(mol•L-1) | 0 | 5 | 10 | 15 | 25 | 30 |
| NO | 1.00 | 0.58 | 0.40 | 0.40 | 0.48 | 0.48 |
| N2 | 0 | 0.21 | a | a | b | b |
| CO2 | 0 | 0.21 | a | a | 0.36 | 0.36 |
②表中25min的数据变化与反应进行到22min时改变了反应体系中的某一条件有关,则b=0.36,改变的条件可能是c.
a.加入一定量的活性炭
b.通入一定量的N2
c.适当缩小容器的体积
③若15min时升高温度,达到平衡时容器中NO、N2、CO2的浓度之比为5:3:3,则△H<0(填“>”、“=”或“<”).
(2)NH3催化还原氮氧化物(产物是N2、H2O)是目前广泛采用的烟气脱氮技术
①当废气中NO2、NO的体积分数相等时脱氮率最高,若此情况下生成1molN2时反应放出的热量为akJ,则对应的热化学方程式为2NH3(g)+NO(g)+NO2(g)=2N2(g)+3H2O(g)△H=-2akJ/mol.

②如图使用不同催化剂时的脱氮率,则脱氮时最佳的温度、催化剂应是Mn、200℃左右.
(3)用石灰浆作吸收剂也可脱去废气中的SO2,若处理结束时,测得吸收液中c(Ca2+)=0.70mol/L,则c(SO32-)=2.0×10-7 mol/L (已知Ksp(CaSO3)=1.4×10-7).
14.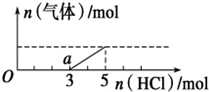 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
 将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )
将一定量的CO2气体通入2L未知浓度的NaOH溶液中,在所得溶液中逐滴加入稀盐酸至过量,并将溶液加热,产生的气体与HCl的物质的量的关系如图所示(忽略气体的溶解和HCl的挥发),下列说法不正确的是( )| A. | O点溶液中所含溶质的化学式为NaOH、Na2CO3 | |
| B. | a点溶液中c (HCO3-)>c (CO32-) | |
| C. | 标准状况下,通入CO2的体积为44.8L | |
| D. | 原NaOH溶液的物质的量浓度为5mol/L |
15.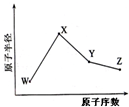 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10,X原子和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法错误的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10,X原子和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法错误的是( )
 W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10,X原子和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法错误的是( )
W、X、Y、Z是四种常见的短周期元素,其原子半径随原子序数变化如图.已知W的一种核素的质量数为18,中子数为10,X原子和Ne原子的核外电子数相差1,Y的单质是一种常见的半导体材料,Z的非金属性在同周期元素中最强.下列说法错误的是( )| A. | 对应简单离子半径X<W | |
| B. | 对应气态氢化物的稳定性Y<Z | |
| C. | 化合物XZW既含离子键又含共价键 | |
| D. | Z或X的最高价氧化物对应的水化物均能与Y的氧化物反应 |