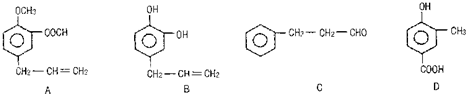
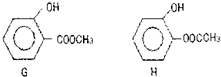
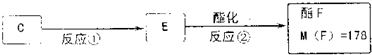题目内容
用NA表示阿伏伽德罗常数的值,下列说法不正确的是( )
| A、常温下,1mol甲烷含有的氢原子数为4NA |
| B、2g氦气所含有原子数为0.5NA |
| C、0.1mol/L的硫酸铝溶液中含SO42-数为0.3NA |
| D、18g水所含质子数为10NA |
考点:阿伏加德罗常数
专题:阿伏加德罗常数和阿伏加德罗定律
分析:A、依据甲烷分子式计算氢原子数;
B、依据n=
计算物质的量,结合分子式计算原子数;
C、溶液体积不知不能计算微粒数;
D、依据n=
计算物质的量,结合分子式计算质子数.
B、依据n=
| m |
| M |
C、溶液体积不知不能计算微粒数;
D、依据n=
| m |
| M |
解答:
解:A、1mol甲烷含有的氢原子数为4NA,故A正确;
B、依据n=
计算物质的量=
=0.5mol,结合氦气是单原子分子,计算原子数0.5NA,故B正确;
C、溶液体积不知不能计算微粒数,故C错误;
D、依据n=
计算物质的量=
=1mol,结合分子式计算质子数为10NA,故D正确;
故选C.
B、依据n=
| m |
| M |
| 2g |
| 4g/mol |
C、溶液体积不知不能计算微粒数,故C错误;
D、依据n=
| m |
| M |
| 18g |
| 18g/mol |
故选C.
点评:本题考查了阿伏伽德罗常数的分析应用,主要是微粒结构和物质的量计算微粒数的分析判断,掌握基础是关键,题目较简单.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
臭氧的化学式为O3.a molO3和a molO2具有相同的( )
| A、原子数 | B、分子数 |
| C、体积 | D、质量 |
 已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X Y W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )
已知:X、Y、Z、W为短周期元素,原子半径X:99pm Y:154pm Z:125pm W:117pm,X Y W位置如图所示(副族省略),X、Y、Z的最高价氧化物对应的水化物相互能反应,下列说法正确的是( )| A、元素Z处于周期表的阴影位置 |
| B、非金属性:X>W |
| C、X与W形成化合物熔点很高,为离子化合物 |
| D、Y、W的最高价氧化物对应的水化物能反应 |
下列物质中不属于烃的是( )
| A、CH4 |
| B、C6H6 |
| C、C2H5Cl |
| D、C2H4 |
下列物质既能与盐酸反应又能与氢氧化钠溶液反应的是( )
①Al②Al2O3③Al(OH3)④Fe.
①Al②Al2O3③Al(OH3)④Fe.
| A、① | B、①② |
| C、①②③ | D、①②③④ |
 已知水在25℃和100℃时,其电离平衡曲线如图所示:
已知水在25℃和100℃时,其电离平衡曲线如图所示: CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.
CO2、SO2、NOx是对环境影响较大的气体,控制和治理CO2、SO2、NOx是解决温室效应、减少酸雨和光化学烟雾的有效途径.