题目内容
15.填空题(1)取1.06g Na2CO3,溶于水配成10mL溶液,则该Na2CO3溶液的物质的量浓度为1mol•L-1,若再往该溶液滴入足量稀盐酸至完全反应,标准状况下生成气体的体积为0.224 L.
(2)怎样用化学方法除去下列物质中混有的少量杂质(用有关反应的离子方程式表示).
①铁粉中混有铝粉2Al+2OH-+2H2O═2AlO2-+3H2↑
②FeCl2溶液中混有CuCl2Fe+Cu2+=Cu+Fe2+
③FeCl3溶液中混有FeCl22Fe2++Cl2═2Fe3++2Cl-.
分析 (1)根据n=$\frac{m}{M}$计算1.06g Na2CO3的物质的量;根据c=$\frac{n}{V}$计算该Na2CO3溶液的物质的量浓度;根据Na2CO3+2HCl=2NaCl+CO2↑+H2O计算生成气体在标准状况下的体积;
(2)①Al与NaOH溶液反应,而Fe不能,以此除杂;
②CuCl2与Fe反应生成氯化亚铁和Cu;
③氯化亚铁与氯气反应生成氯化铁.
解答 解:(1)1.06g Na2CO3,n(Na2CO3)=$\frac{m}{M}$=$\frac{1.06g}{106g/mol}$=0.01mol,c(Na2CO3)=$\frac{n}{V}$=$\frac{0.01mol}{0.01L}$=1mol•L-1;
Na2CO3 +2HCl=2NaCl+CO2↑+H2O
1 1
0.01mol n(CO2)
n(CO2)=0.01mol,V=n×Vm=0.01mol×22.4mol/L=0.224L,
故答案为:1mol•L-1;0.224L;
(2)①Al与NaOH溶液反应,而Fe不能,选NaOH溶液来除杂,发生离子反应为2Al+2OH-+2H2O═2AlO2-+3H2↑,
故答案为:2Al+2OH-+2H2O═2AlO2-+3H2↑;
②CuCl2与Fe反应生成氯化亚铁和Cu,过滤即可除去氯化铜,其反应的方程式为:Fe+Cu2+=Cu+Fe2+;
故答案为:Fe+Cu2+=Cu+Fe2+;
③氯化亚铁与氯气反应生成氯化铁,其反应的离子方程式为:2Fe2++Cl2═2Fe3++2Cl-;故答案为:2Fe2++Cl2═2Fe3++2Cl-.
点评 本题考查了物质的量的计算、有关化学方程式的计算、物质的除杂和方程式的书写,题目难度不大,注意物质的量应用与化学方程式的计算,侧重于考查学生的分析能力和计算能力.

| A. | 绿色食品是不含任何化学物质的食品 | |
| B. | Na2O2与CO2反应,Na2O2是氧化剂、CO2是还原剂 | |
| C. | 向新制的FeSO4溶液中滴入适量的NaOH溶液,放置片刻,整个反应过程的颜色变化是:浅绿色溶液→白色沉淀→灰绿色沉淀→红褐色沉淀 | |
| D. | 称取等质量的两份铝粉,分别加入过量的稀盐酸和过量的NaOH溶液.则放出氢气的体积(同温同压下)不相等 |
| A. | SiO2→H2SiO3 | B. | Na2O2→Na2CO3 | C. | Fe→Fe(OH)3 | D. | Al2O3→Al(OH)3 |
①明矾和FeCl3可作净水剂. ②为保存FeCl3溶液,要在溶液中加少量盐酸. ③AlCl3溶液蒸干,灼烧,最后得到的主要固体产物是Al2O3④NH4Cl与ZnCl2溶液可作焊接中的除锈剂. ⑤实验室盛放NaOH溶液的试剂瓶应用橡皮塞,而不能用玻璃塞. ⑥用NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂. ⑦草木灰与铵态氮肥不能混合施用.
| A. | ①②③⑤⑥⑦ | B. | ①②③④⑥⑦ | C. | ①③⑤⑥⑦ | D. | 全有关 |
属于强电解质的是( )
| A. | ①②③④⑤⑥ | B. | ①④⑤ | C. | ②③④ | D. | ③④ |
| A. | CH2=CH-CH2OH | B. | HO-CH2-CH2-CH2-COOH | ||
| C. | HNO3 | D. | 乙醇 |
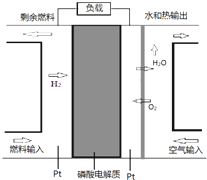 某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点.浓磷酸的凝固点是42°C,PAFC的工作温度通常在150-220°C.以下说法错误的是( )
某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点.浓磷酸的凝固点是42°C,PAFC的工作温度通常在150-220°C.以下说法错误的是( )| A. | 电池中H+向空气输入端的电极移动 | |
| B. | 正极电极反应式:O2+2H2O+4e-═4OH- | |
| C. | 常温下使用该燃料电池性能将降低 | |
| D. | 若以甲醇做燃料,负极电极反应式:CH3OH+H2O-6e-═CO2↑+6H+ |
下列说法中不正确的是( )
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池正极的电极反应式为:MnO2(s)+H2O(l)+e-═MnOOH(s)+OH-(aq) | |
| C. | 电池工作时,锌发生氧化反应 | |
| D. | 当电路中通过0.2mol电子,锌的质量理论上减小6.5g |
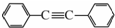 .以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下:
.以互为同系物的单取代芳烃A、G为原料合成M的一种路线(部分反应条件略去)如下: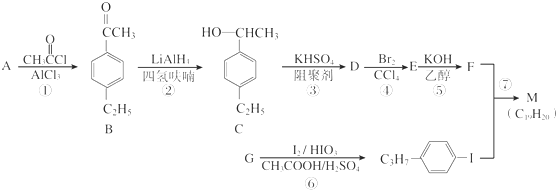
 .
. .
.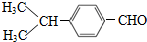 (写结构简式).
(写结构简式).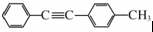 的合成路线:
的合成路线: .
.