题目内容
7.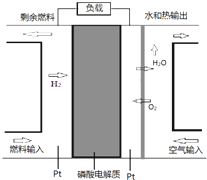 某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点.浓磷酸的凝固点是42°C,PAFC的工作温度通常在150-220°C.以下说法错误的是( )
某种PAFC是以磷酸为电解质、Pt为电极的燃料电池(如图所示),具有电解质稳定、构造简单等特点.浓磷酸的凝固点是42°C,PAFC的工作温度通常在150-220°C.以下说法错误的是( )| A. | 电池中H+向空气输入端的电极移动 | |
| B. | 正极电极反应式:O2+2H2O+4e-═4OH- | |
| C. | 常温下使用该燃料电池性能将降低 | |
| D. | 若以甲醇做燃料,负极电极反应式:CH3OH+H2O-6e-═CO2↑+6H+ |
分析 A.原电池工作时,阳离子向正极移动;
B.浓磷酸为电解质溶液,不可能生成OH-;
C.PAFC的工作温度通常在150-220°C,常温下不反应;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体.
解答 解:A.通入氧气的一极为正极,原电池工作时,阳离子向正极移动,故A正确;
B.浓磷酸为电解质溶液,不可能生成OH-,电极方程式为O2+4e-+4H+=2H2O,故B错误;
C.PAFC的工作温度通常在150-220°C,常温下不反应,故C正确;
D.负极发生氧化反应,甲醇被氧化生成二氧化碳气体,电极方程式为CH3OH+H2O-6e-═CO2↑+6H+,故D正确.
故选B.
点评 本题是对PAFC型燃料电池原理的考查,根据原电池正负极上得失电子及反应类型、离子的移动方向等来分析解答,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.1.52g 铜镁合金完全溶解于50mL 密度为1.40g/mL、质量分数为63%的浓硝酸中,得到NO2和N2O4的混合气体1120mL(标准状况),向反应后的溶液中加入1.0mol/L NaOH溶液,当金属离子全部沉淀时,得到2.54g沉淀.下列说法不正确的是( )
| A. | 该合金中铜与镁的物质的量之比是2:1 | |
| B. | 该浓硝酸中HNO3的物质的量浓度是14.0 mol/L | |
| C. | 得到2.54 g沉淀时,加入NaOH溶液的体积是60 mL | |
| D. | NO2和N2O4的混合气体中,NO2的体积分数是80% |
18.下列说法正确的是( )
| A. | 二氧化碳、甲烷、水汽等都是重要的温室气体 | |
| B. | 化学反应一定伴随能量变化,有能量变化也一定伴随化学反应 | |
| C. | 反应物所具有的总能量比生成物所具有的总能量高的反应是吸热反应 | |
| D. | Ba(OH)2•8H2O与NH4Cl的反应的△H<0 |
2.从化学看生活,你认为下列说法不合理的是( )
| A. | 镁铝合金质量轻、强度大,可用作高铁车厢材料 | |
| B. | 用纸制品、聚乳酸等物质来替代聚乙烯产品,以减少白色污染 | |
| C. | 明矾可用于水的消毒、杀菌 | |
| D. | 大量燃烧化石燃料,是造成雾霾天气的一种原因 |
12.用NA表示阿伏加德罗常数的值,则下列叙述正确的是( )
| A. | 常温常压下,46g有机物C2H60中含有极性键的数目一定为7NA | |
| B. | 标准状况下,22.4L四氯化碳中所含有的共价键数目一定为4NA | |
| C. | 常温常压下,14g乙烯和丙烯的混合气体中含有的原子总数一定为3NA | |
| D. | 标准状况下,22.4L甲烷与22.4L氯气在光照时充分反应,生成的CH3Cl分子数一定为NA |
19.下列叙述正确的是( )
| A. | 顺-2-丁烯和反-2-丁烯的加氢产物不同 | |
| B. | 甲醛、氯乙烯和乙二醇均可作为合成聚合物的单体 | |
| C. | ABS树脂、光导纤维及碳纤维都是有机高分子材料 | |
| D. | 酸性条件下,C2H5CO18OC2H5的水解产物是C2H5CO18OH和C2H5OH |
16.X、Y、Z、W是元素周期表中前20号元素,且原子序数依次增大.X的一种核素在考古时常有来鉴定一些文物的年代;Y的最外层电子数是核外电子层数的3倍;Z元素的最高正价与负价代数和为6;W在前20号元素中的金属性最强.则下列说法正确的是( )
| A. | Z、W简单离子半径大小关系:W>Z | |
| B. | X、Y、Z氢化物的稳定性强弱关系:X>Y>Z | |
| C. | X可与Y和Z分别形成共价化合物 | |
| D. | Y是活泼非金属,与W形成的化合物中不可能含共价键 |
17.原子序数依次增大的X、Y、Z、W四中短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.气体甲由X、Y两种元素组成,其在标准状况下的密度为0.76g•L-1,下列说法正确的是( )
| A. | 非金属性:X<W<Y<Z | |
| B. | X的简单阴离子和Z、W的简单离子均能促进水的电离 | |
| C. | 原子半径:Z<Y<W,而简单离子半径:W<Y<Z | |
| D. | Y的最高价氧化物对应的水化物与W的单质反应可制备X的单质 |