题目内容
5.碱性电池具有容量大、放电电流大的特点,因而得到广泛应用.锌-锰碱性电池以KOH溶液为电解液,电池总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s)下列说法中不正确的是( )
| A. | 电池工作时,电子由正极通过外电路流向负极 | |
| B. | 电池正极的电极反应式为:MnO2(s)+H2O(l)+e-═MnOOH(s)+OH-(aq) | |
| C. | 电池工作时,锌发生氧化反应 | |
| D. | 当电路中通过0.2mol电子,锌的质量理论上减小6.5g |
分析 根据电池总反应式为:Zn(s)+2MnO2(s)+2H2O(l)═Zn(OH)2(s)+2MnOOH(s),可知反应中Zn被氧化,为原电池的负极,负极反应为Zn-2e-+2OH-═Zn(OH)2,MnO2为原电池的正极,发生还原反应,正极反应为MnO2(s)+H2O(l)+e-═MnOOH(s)+OH-(aq),以此解答该题.
解答 解:A、电池工作时,电子由负极通过外电路流向正极,故A错误;
B、MnO2为原电池的正极,发生还原反应,正极反应为MnO2(s)+H2O(l)+e-═MnOOH(s)+OH-(aq),故B正确;
C、根据电池反应式知,锌失电子发生氧化反应,故C正确;
D、负极反应为Zn-2e-+2OH-═Zn(OH)2,外电路中每通过O.2mol电子,消耗的Zn的物质的量为0.1mol,质量为0.1mol×65g/mol=6.5g,故D正确.
故选A.
点评 本题考查了原电池原理的应用,题目难度不大,理解这类题的关键是理解原电池原理,在反应中,电子从负极经外电路流向正极,同时溶液中的阴、阳离子分别不断移向负极、正极,构成闭合回路.

练习册系列答案
相关题目
16.X、Y、Z、W是元素周期表中前20号元素,且原子序数依次增大.X的一种核素在考古时常有来鉴定一些文物的年代;Y的最外层电子数是核外电子层数的3倍;Z元素的最高正价与负价代数和为6;W在前20号元素中的金属性最强.则下列说法正确的是( )
| A. | Z、W简单离子半径大小关系:W>Z | |
| B. | X、Y、Z氢化物的稳定性强弱关系:X>Y>Z | |
| C. | X可与Y和Z分别形成共价化合物 | |
| D. | Y是活泼非金属,与W形成的化合物中不可能含共价键 |
10.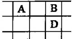 有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )
 有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )
有A、B、C、D、E五种短周期的主族元素,其原子序数依次增大.其中只有C是金属,D的单质是黄色固体,A、B、D在周期表中的相对位置关系如图所示,下列说法正确的是( )| A. | E元素位于周期表中的第三周期、ⅥA族 | |
| B. | B的简单阴离子比D的简单阴离子还原性强 | |
| C. | B与C形成的化合物中一定含有共价键 | |
| D. | A、B两元素形成的常见化合物的分子中均含有极性键 |
17.原子序数依次增大的X、Y、Z、W四中短周期元素,X、W原子的最外层电子数与其电子层数相等,X、Z的最外层电子数之和与Y、W的最外层电子数之和相等.气体甲由X、Y两种元素组成,其在标准状况下的密度为0.76g•L-1,下列说法正确的是( )
| A. | 非金属性:X<W<Y<Z | |
| B. | X的简单阴离子和Z、W的简单离子均能促进水的电离 | |
| C. | 原子半径:Z<Y<W,而简单离子半径:W<Y<Z | |
| D. | Y的最高价氧化物对应的水化物与W的单质反应可制备X的单质 |
17.下列有关说法中不正确的是( )
| A. | 铁与Cl2、盐酸均能发生反应,但生成的含铁物质组成不同 | |
| B. | 分别加热蒸干并灼烧铁、铝的氯化物溶液,最后得到的物质均为金属氧化物 | |
| C. | 等物质的量的Na、Cu、Al与足量氯气反应时,消耗的氯气一样多 | |
| D. | 常温下,铁片、铝片与浓硫酸的反应均只能停留在金属的表面上 |
18.某模拟“人工树叶”电化学实验装置如图所示,该装置能将H2O和CO2转化为O2和燃料(C3H8O). 下列说法正确的是( )

| A. | 该装置将化学能转化为光能和电能 | |
| B. | 该装置工作时,H+从a 极区向b 极区迁移 | |
| C. | 每有44 g CO2被还原,则生成标准状况下 33.6 L O2 | |
| D. | a 电极的反应为:3CO2+16H+-18e-═C3H8O+4H2O |

 +NaHCO3→
+NaHCO3→ +H2O+CO2↑;
+H2O+CO2↑;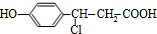 +3NaOH$→_{△}^{水}$
+3NaOH$→_{△}^{水}$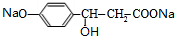 +NaCl+2H2O.
+NaCl+2H2O. 向10L的密闭容器中0.40mol A气体和0.20mol B气体,在一定条件下使其发生反应生成气体C,其物质的量的变化如图:
向10L的密闭容器中0.40mol A气体和0.20mol B气体,在一定条件下使其发生反应生成气体C,其物质的量的变化如图: