题目内容
下列各示意图与对应的表述正确的是( )
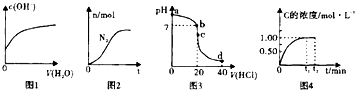

| A、图1表示亚硫酸氢钠溶液加水稀释时,溶液中c(OH-)的变化[已知亚硫酸氢钠溶液c(SO32-)>c(H2SO3)] |
| B、图2表示某离子反应中涉及Cl-,H+,N2,ClO-,NH4-,H2O六种微粒,其中N2的物质的量随时间变化的曲线,反应后溶液的酸性明显减弱 |
| C、图3表示室温下,将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,溶液pH随加入盐酸体积的变化曲线,d点所示溶中离子浓度由大到小的排序是c(Cl+)>c(NH4+)>c(H+)>c(OH+) |
| D、图4表示均为1molA,B气体充入2L恒容密闭容器,发生反应A(g)+B(g)?xC(g)+D(s),C的浓度随时间变化的曲线,则x=2 |
考点:离子浓度大小的比较
专题:盐类的水解专题
分析:A.亚硫酸氢钠溶液c(SO32-)>c(H2SO3),说明亚硫酸氢根离子的电离程度大于其水解程度,溶液显示酸性,稀释后溶液中氢离子浓度减小,氢氧根离子浓度增大;
B.根据曲线变化判断氮气为生成物,再根据氧化还原反应中化合价变化判断反应物、生成物粒子,写出反应的离子方程式即可判断反应后溶液酸性变化;
C.在d点盐酸的体积为40mL,则溶液中c(H+)>c(NH4+);
D.反应初始时A的浓度为0.5mol/L,该反应为可逆反应,当x=2时,A完全反应,违反了可逆反应特点.
B.根据曲线变化判断氮气为生成物,再根据氧化还原反应中化合价变化判断反应物、生成物粒子,写出反应的离子方程式即可判断反应后溶液酸性变化;
C.在d点盐酸的体积为40mL,则溶液中c(H+)>c(NH4+);
D.反应初始时A的浓度为0.5mol/L,该反应为可逆反应,当x=2时,A完全反应,违反了可逆反应特点.
解答:
解:A.亚硫酸氢钠溶液中c(SO32-)>c(H2SO3),则说明亚硫酸氢根离子的水解程度大于水解程度,亚硫酸氢钠溶液为酸性溶液,稀释亚硫酸氢钠溶液后,溶液中氢离子浓度减小,由于水的离子积不变,则溶液中氢氧根离子浓度逐渐增大,图象曲线变化与实际相符,故A正确;
B.根据曲线变化可知,氮气的物质的量逐渐增大,则N2为生成物,氮元素的化合价由-3价升高到0价,根据氧化还原反应元素化合价有升高,必然有元素化合价降低判断,ClO-为反应物,Cl-为生成物,氯元素化合价由+1价降低到-1价,利用化合价升降法及原子守恒和电荷守恒配平的离子方程式为:3ClO-+2NH4+=3H2O+2H++N2↑+3Cl-,反应后溶液酸性明显增强,故B错误;
C.将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,d点盐酸的体积为40mL,则氯化氢是一水合氨物质的量的2倍,反应后的溶液中c(H+)>c(NH4+),故C错误;
D.反应前A的浓度为:
=0.5mol/L,根据图象可知,达到平衡时C的浓度为1mo/L,当x=2时,反应生成1mol/L的C时需要消耗0.5mol/L的A,说明A完全反应,由于该反应为可逆反应,反应物不可能完全参与反应,则x一定大于>2,故D错误;
故选A.
B.根据曲线变化可知,氮气的物质的量逐渐增大,则N2为生成物,氮元素的化合价由-3价升高到0价,根据氧化还原反应元素化合价有升高,必然有元素化合价降低判断,ClO-为反应物,Cl-为生成物,氯元素化合价由+1价降低到-1价,利用化合价升降法及原子守恒和电荷守恒配平的离子方程式为:3ClO-+2NH4+=3H2O+2H++N2↑+3Cl-,反应后溶液酸性明显增强,故B错误;
C.将0.1mol?L-1盐酸滴入20mL0.1mol?L-1氨水中,d点盐酸的体积为40mL,则氯化氢是一水合氨物质的量的2倍,反应后的溶液中c(H+)>c(NH4+),故C错误;
D.反应前A的浓度为:
| 1mol |
| 2L |
故选A.
点评:本题考查了离子浓度大小比较、可逆反应特点、氧化还原反应及其应用等知识,题目难度中等,试题涉及的知识点较多、综合性较强,充分考查了学生的分析、理解能力及灵活应用所学知识的能力,选项D为易错点,注意可逆反应特点.

练习册系列答案
相关题目
下列说法正确的是( )
| A、刚玉的主要成分是二氧化硅,红宝石、蓝宝石是含少量不同金属氧化物的优质刚玉 |
| B、蛋白质水解后只生成一种纯净的物质--氨基酸 |
| C、所有金属及其化合物在火焰上灼烧,都会使火焰呈现特征颜色,即焰色反应 |
| D、生铁比纯铁易受腐蚀,减少钢铁中的含碳量,可以增强钢铁的耐腐蚀能力 |
对于白磷引起的中毒,硫酸铜溶液是一种解毒剂,有关反应为:11P4+60CuSO4+96H2O=20Cu3P+24H3PO4+60H2SO4.下列关于该反应的说法正确的是( )
| A、CuSO4发生了氧化反应 |
| B、氧化产物和还原产物的物质的量之比为5:6 |
| C、白磷只作还原剂 |
| D、该反应中被硫酸铜氧化的白磷有3mol |
下列有关说法正确的是( )
| A、反应SiO2(s)+3C(s)=SiC(s)+2CO(g)室温下不能自发进行,则该反应的△H<0 | ||||
| B、铅蓄电池放电过程中,正极质量增加,负极质量减小 | ||||
C、25℃下,在NH3?H2O稀溶液中,加水,
| ||||
| D、在NaHS溶液中,滴入少量CuCl2溶液产生黑色沉淀,HS-水解程度增大,pH增大 |
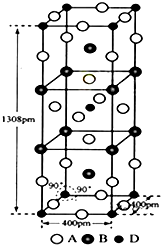 前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题:
前四周期元素A,B,C,D原子序数依次增大,A和B的价层电子只有一个单电子,且A-和B+的电子数相差8;C和D与B同周期,C和D的价层电子中未成对电子分别为4和2,且原子序数相差2.回答下列问题: (1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应:
(1)三种弱酸HA、H2B、HC,电离常数为1.8×10-5、5.6×10-11、4.9×10-10、4.3×10-7(数据顺序已打乱),已知三种酸和它们的盐之间能发生以下反应: